
【题目】已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是
A. 向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B. 将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L
C. 因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生
D. 除去工业废水中的Cu2+可以选用FeS作沉淀剂
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
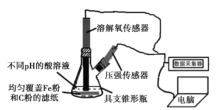
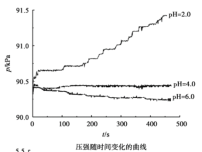
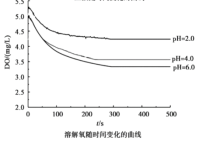
下列说法不正确的是
A.压强增大主要是因为产生了H2
B.整个过程中,负极电极反应式为:Fe–2e- = Fe2+
C.pH= 4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D.pH= 2.0时,正极电极反应式为:2H+ + 2e- = H2↑ 和 O2 + 4e- + 4H+ = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
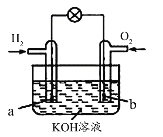
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH――4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.溶液中OH-向正极移动,K+、H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和乙醇在浓硫酸作用下制取乙酸乙酯的装置如图。下列说法正确的是
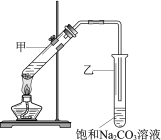
A. 向甲试管中先加浓硫酸,再加乙醇和乙酸
B. 乙试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙酸,可使乙醇完全转化为乙酸乙酯
D. 实验完毕,可将乙酸乙酯从混合物中过滤出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是

A. 冰表面第一层中,HCl以分子形式存在
B. 冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
C. 冰表面第三层中,冰的氢键网格结构保持不变
D. 冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
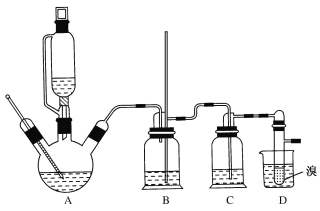
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molBaCl2晶体中所含离子总数为0.2NA
B.25℃时,pH=1的HC1溶液中含有H+的数目为0.1NA
C.17gH2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如下表:


(1)写出Na2O2和H2O反应的化学方程式_______。
(2)计算过氧化钠质量分数时,除了试样的质量,锥形瓶和水的质量,还必需的数据是______,不必作第6次读数的原因是______。
(3)根据上述数据,过氧化钠的质量分数是_____(保留2位小数)。
(4)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如图:
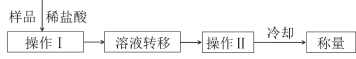
①操作Ⅰ的名称是_____。
②需直接测定的物理量是_____。
③操作Ⅱ需要的仪器除了酒精灯,还需要_____(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_____(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com