
| ʱ��/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A�� | ��Ӧ��ǰ50s��ƽ����Ӧ����Ϊv��PCl3��=0.0064 mol/��L•s�� | |
| B�� | �����������������䣬�����¶ȣ�ƽ��ʱc��PCl3��=0.11 mol/L����Ӧ�ġ�H��0 | |
| C�� | ��ͬ�¶��£���ʼʱ��������г���4.0 mol PCl3��4.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80% | |
| D�� | ��ͬ�¶��£���ʼʱ��������г���2.0 mol PCl5��0.40 mol PCl3��0.40 mol Cl2���ﵽƽ��ǰv��������v���棩 |
���� A����Ӧ����v=$\frac{��c}{��t}$����õ���
B�������¶ȣ�ƽ��ʱ��c��PCl3��=0.11 mol•L-1������ͼ����PCl3Ũ�ȣ�˵������ƽ��������У�����ӦΪ���ȷ�Ӧ��
C�����ͼ�����ݼ���ƽ�ⳣ�����淴Ӧƽ�ⳣ����������Ӧƽ�ⳣ����������ʽ�������Ȼ���ת���ʣ�
D������Ũ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з���
��� �⣺A����Ӧ��ǰ50 s��ƽ������Ϊv��PCl3��=$\frac{\frac{0.32mol}{4L}}{50s}$=0.0016 mol•L-1•s-1����A����
B�������¶ȣ�ƽ��ʱ��c��PCl3��=0.11 mol•L-1������ͼ����PCl3Ũ��=$\frac{0.4mol}{4L}$=0.1mol/L��˵������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0����B����
C��ƽ���PCl3���ʵ���Ϊ0.4mol��
PCl5��g��?PCl3��g��+Cl2��g��
��ʼ����mol/L�� 0.5 0 0
�仯����mol/L��0.1 0.1 0.1
ƽ������mol/L��0.4 0.1 0.1
ƽ�ⳣ��K=$\frac{0��{1}^{2}}{0.4}$=0.025���淴Ӧƽ�ⳣ��K=$\frac{1}{0.025}$=40��
��ͬ�¶��£���ʼʱ�������г���4.0molPCl3��4.0molCl2���ﵽƽ��ʱ����PCl3 ���ʵ���Ũ��Ϊx��
PCl5��g��?PCl3��g��+Cl2��g��
��ʼ����mol/L�� 0 1 1
�仯����mol/L�� x x x
ƽ������mol/L�� x 1-x 1-x
K=$\frac{x}{��1-x��^{2}}$=40��x=0.8mol/L��PCl3��ת���ʵ���80%����C����
D����ͬ�¶��£���ʼʱ�������г���2.0molPCl5��0.40molPCl3��0.40molCl2������Ũ�ȷֱ�Ϊ0.5mol/L��0.1mol/L��0.1mol/L�����Ũ����Q=$\frac{0.1��0.1}{0.5}$=0.02��K=0.025����Ӧû�дﵽƽ��״̬����Ӧ������У��ﵽƽ��ǰv��������v���棩����D��ȷ��
��ѡD��
���� ���⿼���˻�ѧƽ��ļ��㡢Ӱ��ƽ��������Լ�ƽ�ⳣ�����㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע������ʽ����ƽ������е�Ӧ�ã���Ŀ�Ѷ��еȣ�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮϴ���ձ���������2��3�Σ�ÿ��ϴ�Ӻ����Һ��ע������ƿ�� | |
| B�� | �ѳ�����NaOH�������ʢ����������ˮ���ձ��У��ܽ����������Һת�Ƶ�����ƿ�� | |
| C�� | ��������ƽ�����������ϸ���һ�Ŵ�Сһ����ֽ��Ȼ��NaOH�������ֽ�Ͻ��г��� | |
| D�� | ���Ų�����������ƿ�м�������ˮ��ֱ����Һ��Һ��ǡ����̶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
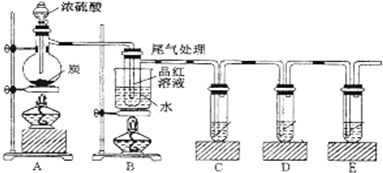
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
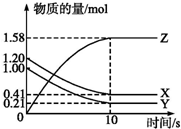 һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ij��ѧ��ȤС�鰴��ͼ��ʾװ��̽��ͭ��Ũ���ᷴӦ�������¶ȵ����ߣ��а������������շ���ͭ�����ڣ�����ϸС��ɫ���������ɣ��Թ�B���а�ɫ�������ɣ�
ij��ѧ��ȤС�鰴��ͼ��ʾװ��̽��ͭ��Ũ���ᷴӦ�������¶ȵ����ߣ��а������������շ���ͭ�����ڣ�����ϸС��ɫ���������ɣ��Թ�B���а�ɫ�������ɣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������W���淴Ӧ�������� | |
| B�� | ������Ӧ���ȣ����������¶�����Ӧ���ʼӿ죬�淴Ӧ���ʼ��� | |
| C�� | ��v��X��=v��Z��ʱ����Ӧ�ﵽƽ�� | |
| D�� | ���������ܶȲ���ʱ����Ӧ�ﵽƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���淴Ӧ���ʶ����� | |
| B�� | ƽ�ⲻ�ƶ� | |
| C�� | �ٴ�ƽ��ʱc��D�� ���� | |
| D�� | C������������ٱ仯˵���ٴδﵽƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����κλ�ѧ��Ӧ��˵����Ӧ����Խ��Ӧ����Խ���� | |
| B�� | ��ѧ��Ӧ����Ϊ��0.8mol/��L•min������ʾ����˼�ǣ�ʱ��Ϊ1sʱ��ij���ʵ�Ũ��Ϊ0.8mol/L | |
| C�� | ��ѧ��Ӧ�ﵽƽ��״̬����Ӧֹͣ | |
| D�� | ��ѧ��Ӧ�����Ƕ���������ѧ��Ӧ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������������������ֱ���ȫȼ�գ����߷ų������� | |
| B�� | �ɡ�C��ʯī���TC�����ʯ����H=1.9 kJ•mol����֪�����ʯ��ʯī�ȶ� | |
| C�� | ��101 kPaʱ��2 g H2 ��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��l����H=-285.8 kJ/mol | |
| D�� | ��ϡ��Һ�У�H++OH-�TH2O��H=-57.3 kJ•mol��������1 mol H2SO4�뺬2 mol NaOH����Һ��ϣ��ų�����������114.6 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com