
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

完成下列填空:
(1)写出烧瓶中生成SO2的化学方程式__。
(2)细铜丝表面的实验现象是__,使用细铜丝的原因是__。
(3)欲使反应停止,应进行的操作是__,反应一段时间以后,将烧瓶中液体冷却后,可观察到白色固体,推断该白色固体是__,理由是__。
(4)将Na2O2粉末沾在玻璃棉上的目的是__,若Na2O2与SO2完全反应,生成Na2SO3、O2和Na2SO4。为检验混合物中有Na2SO4,实验方案是__。
(5)实验装置中广口瓶的作用是__。在含0.1molNaOH的溶液中不断地通入SO2,得到溶质的质量为8.35g,则烧杯中生产的溶质是__。两者的物质的量之比为__。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 有气泡产生,细铜丝溶解 增大接触面以加快反应速率 先抽拉粗铜丝使细铜丝与浓硫酸脱离接触,再撤去酒精灯 无水硫酸铜 浓硫酸具有吸水性,无水硫酸铜固体在浓硫酸中溶解度很小而析出 使Na2O2与SO2充分接触,有利于反应完全进行 取样,滴加足量稀盐酸,再滴加BaCl2溶液,产生白色沉淀,即可证明有Na2SO4生成 防倒吸 Na2SO3、NaHSO3 n(Na2SO3)/n(NaHSO3)=1:2(顺序相反时,则为2:1)
CuSO4+SO2↑+2H2O 有气泡产生,细铜丝溶解 增大接触面以加快反应速率 先抽拉粗铜丝使细铜丝与浓硫酸脱离接触,再撤去酒精灯 无水硫酸铜 浓硫酸具有吸水性,无水硫酸铜固体在浓硫酸中溶解度很小而析出 使Na2O2与SO2充分接触,有利于反应完全进行 取样,滴加足量稀盐酸,再滴加BaCl2溶液,产生白色沉淀,即可证明有Na2SO4生成 防倒吸 Na2SO3、NaHSO3 n(Na2SO3)/n(NaHSO3)=1:2(顺序相反时,则为2:1)
【解析】
在圆底烧瓶中,铜与浓硫酸在加热的条件下反应生成硫酸铜,二氧化硫和水,反应过程中,铜丝溶解,有气泡生成,使用细铜丝来增大接触面积,反应结束后,先抽拉粗铜丝使细铜丝与浓硫酸脱离接触,再撤去酒精灯,试验后的烧瓶中含有浓硫酸和硫酸铜,从生成物的角度分析白色固体,玻璃管中Na2O2粉末散附在玻璃棉上可使SO2与Na2O2充分接触,B中发生SO2+Na2O2=Na2SO4,可能混有Na2SO3,且亚硫酸钡可溶于盐酸,硫酸钡不能溶于盐酸,烧杯中NaOH吸收尾气,易发生倒吸,应在烧杯与集气瓶之间加一个防倒吸装置,以此来解答。
(1)烧瓶中生成SO2的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)实验中可观察到细铜丝表面:有气泡产生,细铜丝溶解;
(3)欲使反应停止,应进行的操作是:先抽拉粗铜丝使细铜丝与浓硫酸脱离接触,再撤去酒精灯;烧瓶中液体冷却后,可观察到的现象是有白色固体生成,溶液变为无色,原因是浓硫酸具有吸水性,无水硫酸铜固体在浓硫酸中溶解度很小而析出;
(4)把Na2O2粉末散附在玻璃棉上的目的是:使Na2O2与SO2充分接触,检验混合物中有Na2SO4的实验方案是:取样,滴加足量稀盐酸,排除亚硫酸根的干扰,再滴加BaCl2溶液,产生白色沉淀,即可证明有Na2SO4生成;
(5)氢氧化钠溶液吸收尾气,会引起倒吸,实验装置中广口瓶的作用是防止倒吸,
SO2与NaOH的溶液反应可能产生亚硫酸钠或亚硫酸氢钠,或者是亚硫酸钠和硫酸钠的混合物,已知氢氧化钠的物质的量n(NaOH)=0.1mol,假设生成物全部是亚硫酸钠,发生反应:SO2+2NaOH=Na2SO3+H2O, 2mol氢氧化钠生成1mol亚硫酸钠,0.1mol氢氧化钠生成0.05mol亚硫酸钠,质量为m=nM=0.05mol×126g/mol=6.3g,假设生成物全部是亚硫酸氢钠,发生反应:SO2+NaOH=NaHSO3,1mol氢氧化钠生成1mol亚硫酸氢钠,0.1mol氢氧化钠生成0.1mol亚硫酸氢钠,质量为m=nM=0.1mol×104g/mol=10.4g,得到溶质的质量为8.35g,故生成物既有亚硫酸钠,又有亚硫酸氢钠,设生成亚硫酸钠反应消耗的氢氧化钠为xmol,生成亚硫酸氢钠反应消耗的氢氧化钠的物质的量为ymol,则有:
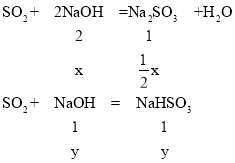
x+y=0.1,![]() x×126+104y=8.35,解得x=0.05,y=0.05,
x×126+104y=8.35,解得x=0.05,y=0.05,![]() =
=![]() x:y=1:2。
x:y=1:2。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
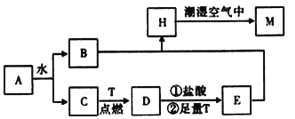
(1)物质D的化学式为 ________。
(2)A和水反应生成B和C的离子方程式为____________________,列出A的一种重要用途_________________。
(3)H在潮湿空气中变成M的实验现象是______________________。
(4)反应①的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.加入AgNO3溶液,生成白色沉淀,加稀硝酸沉淀不溶解时,能确定有Cl-存在
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氯气通入100mL4mol·L-1的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
A.当通入的Cl2为2.24L时,反应中电子转移数目为0.1NA
B.当电子转移数目为0.2NA时,溶液质量增加14.2g
C.当溶液中Na+为0.4NA时,溶液中的Cl-为0.2NA
D.当溶液质量增加7.1g时,溶液中ClO-为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
完成下列填空:
(1)将二氧化氯通入品红试液中,看到的现象是__;理由是__。
(2)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
___CH3OH+__NaClO3+__→__CO2↑+__C1O2↑+__Na2SO4+__□__
(3)该反应中,被氧化的元素是__。还原产物与氧化产物的物质的量之比是__。
(4)根据上述反应可推知__。
a.氧化性:C1O2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为__升。
(6)消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的__倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固定烟气中CO2的工艺流程如下:
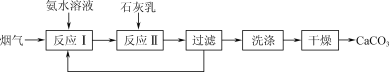
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
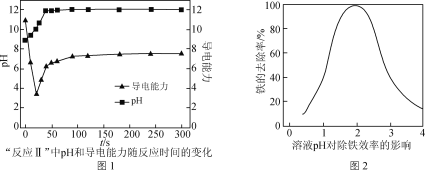
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
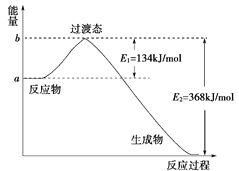
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
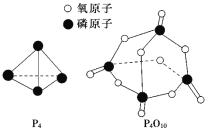
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 从1 L 1 mol/L的氯化钠溶液中取出10 ml,其浓度仍是1 mol/L
B. 制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C. 10 g 98%硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
D. 0.5 L 2 mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com