
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| 1 |
| 6 |
| 1 |
| 6 |
|


科目:高中化学 来源: 题型:
| A、物质失去电子数越多,物质的还原性越强 |
| B、导电的不一定是电解质,电解质不一定导电 |
| C、得到电子的物质是还原剂 |
| D、还原剂反应后得到是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | A | B | C | D |
| △H/kJ?mol-1 | 10.5 | 1.80 | -126 | -11.7 |
| △S/J?mol-1?K-1 | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流大小/?A |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹 果 | 2 | 27.2 |
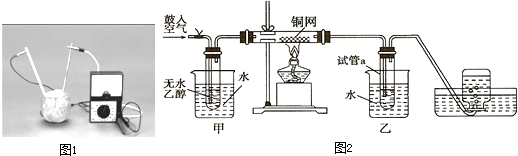
查看答案和解析>>
科目:高中化学 来源: 题型:
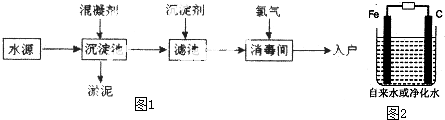
查看答案和解析>>
科目:高中化学 来源: 题型:
 i.
i. j.
j. k.
k.
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.查看答案和解析>>
科目:高中化学 来源: 题型:
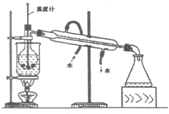 实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)
实验室里化学兴趣小组的探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液(含I-),接下来的流程如下:(每一步反应均充分)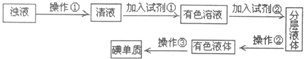
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素只以化合态存在于自然界中 |
| B、随核电荷数增加,单质熔沸点降低 |
| C、随核电荷数增加,单质氧化性增强 |
| D、单质与水反应的通式均为X2+H2O=HX+HXO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com