
 ��֪��ͭ���ӵ���ɫ��Ҫ��Cu��H2O��42+����ɫ����CuCl42-����ɫ����Cu��NH3��42+������ɫ���ȣ�
��֪��ͭ���ӵ���ɫ��Ҫ��Cu��H2O��42+����ɫ����CuCl42-����ɫ����Cu��NH3��42+������ɫ���ȣ����� ��1��Cu������Cl2��ȼ������CuCl2��16gCu�����ʵ���Ϊ0.25mol��
��2�����Ȼ�ͭ��Һ�еμӰ�ˮ����������������Cu��NH3��42+����Ӧ��������ɫCu��OH��2������Ȼ������ܽ���������ɫ��Һ�����к���Cu��NH3��42+��
��3���ٷ�ӦΪ��Cu��H2O��42+��aq��+4Cl-��aq��?CuCl42- ��aq��+4H2O��l������ѧƽ�ⳣ������ʽ��Ӧ�������ӵ�ϵ�����ݣ�
�ڸ��ݷ�Ӧ����ʽ����Cl-����ʼŨ�ȣ�ת����Ũ������ʼŨ�ȵı�ֵ�İٷ�����Ϊƽ��ת���ʣ�
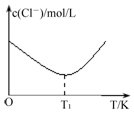
��c1mol/LCuCl2��Һ��c2mol/L HCl��Һ�������ϣ���Ӧ����CuCl42-������T1 Kʱ�������¶����ߣ���Һ��c��Cl-��������CuCl42-�Ľ��룻
���ö��Ե缫���Ũ�Ƚϴ�CuCl2��Һ������Ϊ���ʵõ����ӣ�������ԭ��Ӧ������һ���̶ȣ���������������ɫCu��OH��2��״������²������������Һ��pH=m�������ܶȻ�����������������c��Cu2+����
��� �⣺��1��Cu������Cl2��ȼ������CuCl2��16gCu�����ʵ���Ϊ0.25mol����1molCu��Ӧ�ų�����227.2kJ/mol��
��ͭ��������ȼ�յ��Ȼ�ѧ����ʽΪ��Cu��s��+Cl2�TCuCl2��s����H=-227.2kJ/mol��
�ʴ�Ϊ��Cu��s��+Cl2�TCuCl2��s����H=-227.2kJ/mol��
��2�����Ȼ�ͭ��Һ�еμӰ�ˮ����������������Cu��NH3��42+����Ӧ��������ɫCu��OH��2������Ȼ������ܽ���������ɫ��Һ�����к���Cu��NH3��42+����۲쵽�������ǣ���ɫ��Һ��������ɫ���������������ܽ⣬���ձ������ɫ��Һ��
�ʴ�Ϊ����ɫ��Һ��������ɫ���������������ܽ⣬���ձ������ɫ��Һ��
��3���ٷ�ӦΪ��Cu��H2O��42+��aq��+4Cl-��aq��?CuCl42- ��aq��+4H2O��l������÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ��K=$\frac{c��CuC{l}_{4}^{2-}��}{{c}^{4}��C{l}^{-}��c[Cu��{H}_{2}O��_{4}^{2+}]}$��
�ʴ�Ϊ��K=$\frac{c��CuC{l}_{4}^{2-}��}{{c}^{4}��C{l}^{-}��c[Cu��{H}_{2}O��_{4}^{2+}]}$��
�ڳ����£��ⶨƽ����ϵ�У�Cu��H2O��42+Ũ��Ϊa mol/L��Cl-Ũ��Ϊb mol/L��CuCl42-Ũ��Ϊc mol/L�����ݷ�Ӧ����ʽ������ʼʱc��Cl-��=��b+4c��mol/L����Cl-��ƽ��ת����Ϊ��=$\frac{4c}{b+4c}��100%$��
�ʴ�Ϊ��$\frac{4c}{b+4c}��100%$��
��c1mol/LCuCl2��Һ��c2mol/L HCl��Һ�������ϣ���Ӧ����CuCl42-������T1 Kʱ�������¶����ߣ���Һ��c��Cl-��������CuCl42-�Ľ��룬�����������¶����ߣ�����CuCl42-�Ľ��룬
�ʴ�Ϊ���¶����ߣ�CuCl42-��������Cu��H2O��42+��Cl-��
��4���ö��Ե缫���Ũ�Ƚϴ�CuCl2��Һ������Ϊ���ʵõ����ӣ�������ԭ��Ӧ���������ĵ缫��ӦʽΪ��Cu2++2e-=Cu������һ���̶ȣ���������������ɫCu��OH��2��״������²������������Һ��pH=m����c��OH-��=10m-14mol/L�����ʱ��������c��Cu2+��=$\frac{{K}_{sp}[Cu��OH��_{2}]}{{c}^{2}��O{H}^{-}��}$=$\frac{2.2��1{0}^{-20}}{��1{0}^{m-14}��^{2}}$=2.2��108-2mmol/L��
�ʴ�Ϊ��Cu2++2e-=Cu��2.2��108-2m��
���� ���⿼�黯ѧԭ������֪ʶ�������������γɣ��Ȼ�ѧ����ʽ����д����ѧƽ�ⳣ���ı���ʽ����д���绯ѧԭ�����ܶȻ������ļ��㣬��Ϊ��Ƶ���㣬��Ŀ�ѶȲ����ǻ����⣮


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǻ��ĵ���ʽ�� | B�� | ��������ʽ��CH3COOH | ||
| C�� | ����ȩ�Ľṹ��ʽ��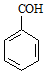 | D�� | 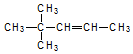 ��ϵͳ����Ϊ��4��4����-2-��ϩ ��ϵͳ����Ϊ��4��4����-2-��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 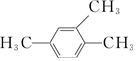 1��3��4-���ױ� 1��3��4-���ױ� | |
| B�� | 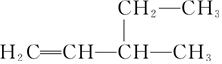 3-�һ�-1-��ϩ 3-�һ�-1-��ϩ | |
| C�� |  2-��-2��4-����ϩ 2-��-2��4-����ϩ | |
| D�� | 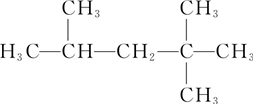 2��4��4-�������� 2��4��4-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ����� | �Լ� | ���뷽�� | |
| A | �������ӣ� | ��ˮ | ���� |
| B | ���飨��ϩ�� | ���� | ���� |
| C | �Ҵ������ᣩ | CaO | ���� |
| D | C17H35COONa�����ͣ� | NaCl | ��Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ܶȲ��ٱ仯 | |
| B�� | ��������ƽ����Է����������ٱ仯 | |
| C�� | ���������NO2��NO��O2�����ʵ���֮��Ϊ2��2��1 | |
| D�� | ��λʱ��������2n mol NO��ͬʱ����2n mol NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Xm-�У���ԭ�ӹ�����ӻ�������sp2��sp3 | |
| B�� | ��λ��������4��5ԭ��֮�� | |
| C�� | m=3 | |
| D�� | ��ɰ������Na+��Xm-��H2O���ɣ�����֮����ڵ��������й��ۼ������»�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
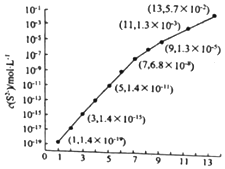 25�棬��0.10mol•L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c��S2-����ϵ��ͼ ��������Һ����ı仯��H2S�Ļӷ�����
25�棬��0.10mol•L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c��S2-����ϵ��ͼ ��������Һ����ı仯��H2S�Ļӷ������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com