
【题目】某未知溶液可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和K+。取100mL该溶液进行实验,过程记录如下。由此可知原溶液中
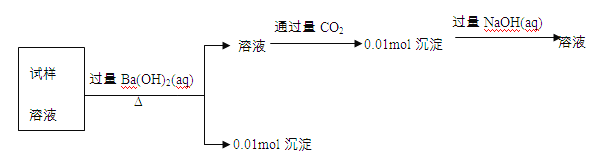
A.一定有Cl- B.一定有CO32- C.一定没有K+ D.一定没有Mg2+
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
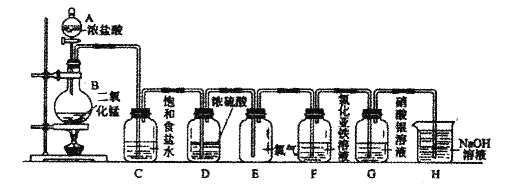
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
_________________________________________________________
(2)C中盛有饱和食盐水,其作用是________________________________,D中浓硫酸的作用是___________________________________。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为___________________
(4)G中是AgNO溶液,现象是______________________________
(5)H中盛有Na0H溶液,其作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )
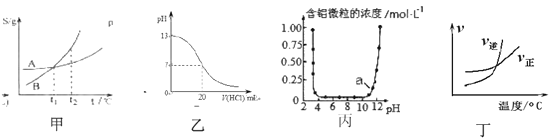
A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。实验室常用CaCO3为原料制备过氧化钙,流程如下:CaCO3![]() 滤液
滤液![]() 白色结晶(CaO2)。下列说法不正确的是( )
白色结晶(CaO2)。下列说法不正确的是( )
A.逐滴加入稀盐酸后,将溶液煮沸的作用是除去溶液中多余的HCl
B.加入氨水和双氧水后的反应为:CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O
C.生成CaO2的反应需要在冰浴下进行的原因是温度过高时过氧化氢分解
D.过滤得到的白色结晶用蒸馏水洗涤后应再用乙醇洗涤以去除结晶表面水分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:
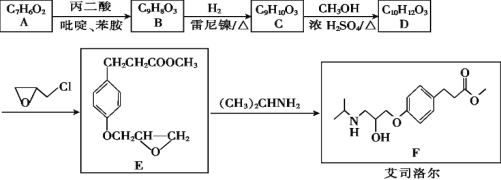
回答下列问题:
(1)丙二酸的结构简式为_______;E中含氧官能团的名称是_______。
(2)D生成E的反应类型为____________。
(3)C的结构简式为________________。
(4)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成1 mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为____。
(5)X是B的同分异构体,X同时满足下列条件的结构共有____种,其中核磁共振氢谱有五组峰的结构简式为____。
①可与碳酸氢钠溶液反应生成二氧化碳
②遇FeCl3溶液发生显色反应
③除苯环外不含其他环
(6)写出以苯甲醇和丙二酸为原料制备![]() 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | I | II | III | IV |
盐酸体积(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(NaHCO3):n(Na2CO3)=___。
(2)盐酸的物质的量浓度c(HCl)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com