
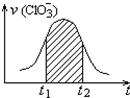
 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
分析 A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.由方程式,根据速率之比等于化学计量数之比判断;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.由方程式,根据改变的物质的量之比等于化学计量数之比.
解答 解:A.由方程式:ClO3-+HSO3--SO42-+Cl-+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.该方程式为ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(H+)=1:3,纵坐标为v(H+)的v-t曲线与图中曲线不重合,故B正确;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.由ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加或者是ClO3-浓度的减小,故D错误;
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握浓度、温度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意阴影为浓度变化量,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(气)-→H2O(液)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化都表现为热量的变化 | |
| D. | 所有的物质一定存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41 | B. | 42 | C. | 44 | D. | 46 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性减弱 | |
| B. | 放电时,电子由Zn经导线转移到K2FeO4 | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被还原 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 0.1 mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HS${o}_{3}^{-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com