
1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+aY(g) bZ(g)
bZ(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=3
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.溶度积大的化合物溶解度一定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,又达到平衡时,AgCl的溶解度不变,溶度积也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl是弱电解质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.0.1 mol·L-1的醋酸加水稀释,c(H+)/c(OH-)减小
B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大
D.V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )
2HBr(g) ΔH<0。当温度分别为T1,T2,平衡时,H2的体积分数与Br2(g)的物质的量的变化关系如图所示。下列说法不正确的是 ( )

A.由图可知:T1>T2
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
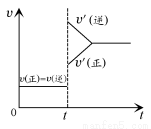
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.I2(g)转化率增大,HI平衡浓度变小
D.改变条件前后,速率图像如图所示
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
加0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g· mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
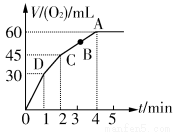
(1)实验时放出气体的总体积是_____________________________。
(2)放出一半气体所需时间为_______________________________。
(3)反应放出气体总体积的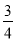 所需的时间约为__________________
所需的时间约为__________________
(4)A、B、C、D各点反应速率快慢的顺序为____________________
(5)解释反应速率变化的原因___________________________________________________
(6)计算H2O2的初始物质的量浓度____________________
(7)求反应到2 min时,H2O2的质量分数_________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
如图所示,用石墨电极电解氯化铜溶液。查阅资料可知,CuCl42—显黄色,氯化铜溶液显蓝绿色或黄绿色;向体积相同浓度分别为0.01 mol/L、0.05 mol/L、0.1 mol/L、0.5 mol/L的氯化铜溶液中加入NaCl至饱和,对比发现,溶液的颜色由黄绿色向蓝绿色转变。
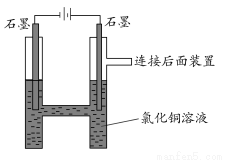
请回答下列问题:
(1)阳极上的气体呈________色,检验该气体可用________________。
(2)写出电解的离子方程式:________________。
(3)实验时,装置中阴极溶液颜色由蓝绿色变为黄绿色,原因是________。
(4)取出阴极的石墨棒,发现表面有浅蓝色固体,试设计实验探究此浅蓝色固体的成分:
____________________________________________________。
(5)为什么要设计连接后面的装置?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
参照反应Br+H2 HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
HBr+H的能量对反应历程的示意图。下列叙述正确的是( )
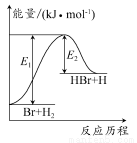
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com