
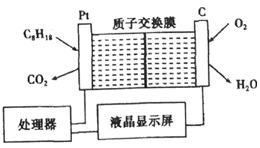
 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
分析 该原电池中,铂电极上锌C8H18失电子发生氧化反应而作负极,电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+,石墨作正极,正极上氧气得电子发生还原反应,电极反应式:4H++O2+4e-═2H2O,在原电池中,阳离子移向正极,电子不能通过电解质溶液,据此分析判断.
解答 解:A.石墨作正极,正极上氧气得电子发生还原反应,故A正确;
B.铂电极上锌C6H18失电子发生氧化反应而作负极,电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+,故B正确;
C.每消耗标准状况下5.6 L O2,物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,强酸性溶液作电解质溶液中电极反应4H++O2+4e-═2H2O,电子守恒得到通过lmol 电子,但溶液中不能通过电子,故C错误;
D.阳离子移向正极,所以H+由质子交换膜左侧向右侧迁移,故D正确;
故选C.
点评 本题考查了原电池原理,根据电极反应式中元素化合价变化来确定正负极,结合正负极反应式判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N A | |
| D. | 常温常压下,2.24L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:
硫酸是一种重要的基本化工原料,我国的硫磺资源相对短缺,主要用黄铁矿(FeS2,其中S为-1价)生产硫酸的重要原料,生产过程中主要有三个步骤:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,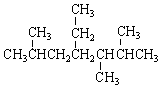 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 肌醇 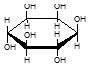 与葡萄糖 与葡萄糖 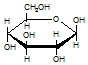 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 1.0 mol的 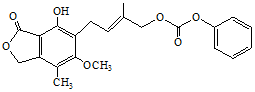 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 | |
| 将苯滴入溴水中,振荡,静置 | 溴水层褪色 | 溴和苯发生加成反应 | |
| 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 | |
| 相同的铝片分别与同温同体积,且c(H+)=1mol•L-1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,X是待保护金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol NaOH的摩尔质量为80g/mol | |
| B. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA | |
| C. | 1molNa2O2与足量CO2反应转移的电子数为2NA个 | |
| D. | 0.1molKHSO4晶体中阳离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{HBr溶液}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH的乙醇溶液}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 稳定性:NH3<PH3<SiH4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com