
| A. | 9mol/L | B. | 5mol/L | C. | 4mol/L | D. | 1mol/L |
分析 利用氯气在标况下的体积来计算其物质的量,然后利用化学方程式计算参加反应的HCl的物质的量,根据c=$\frac{n}{V}$计算原浓盐酸的物质的量浓度.
解答 解:氯气的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,则由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,参加反应的HCl的物质的量为0.4mol,又剩余溶液中盐酸的浓度为lmol/L,所以原浓盐酸的物质的量浓度c=$\frac{n}{V}$=$\frac{0.4mol+1mol/L×0.1L}{0.1L}$=5mol/L,故选:B.
点评 本题考查学生利用化学反应方程式的计算,明确氯气的物质的量代入计算是解答本题的关键,并注意结合氧化还原反应来解答.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标况下,某活泼金属转移2NA个电子时,可以与盐酸反应产生44.8LH2 | |
| B. | 由Na2O2制得2.24L标况下的O2,转移的电子数目为0.4NA | |
| C. | 若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA | |
| D. | 常温常压下,0.1molCl2溶于水,转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2molH2SO4 | B. | 0.4molH2O2 | C. | 0.6molHNO3 | D. | 0.8molNaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| B. | “地沟油”禁止食用,但可以用来制造肥皂或生物柴油 | |
| C. | 聚乙烯塑料老化是因为发生了加成反应 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和的胆矾溶液中加入一些无水硫酸铜粉末,很快有较多量的蓝色晶体形成 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是光纤制品的主要化学成分 | B. | 合金至少含两种以上的金属元素 | ||
| C. | 胶体可产生丁达尔效应 | D. | 石油分馏可获得乙烯、丙烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素的金属性一定比第ⅡA族元素的金属性强 | |
| B. | 第VIIA族元素从上到下,其氢化物的还原性依次减弱 | |
| C. | 第三周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
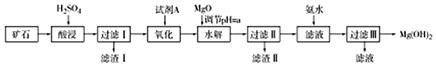
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com