
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
【答案】B MoO3+CO32-=MoO42-+CO2↑ MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O (NH4)2CO3或(NH4)2SO3 1:1 常温下浓硫酸具有强氧化性,会使铁钝化 nMoS2+xLi++xe-=Lix(MoS2)n ![]()
【解析】
(1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低,陶瓷属于无机非金属材料,二氧化锆为化合物无丁达尔效应;
(2)①途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
(4)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
(5)根据电池放电时的正极MoS2得电子发生还原反应书写;利用途径I,使所有的Mo转化为钼酸钠晶体,根据得失电子守恒计算。
(1)A.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故 A错误;
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
B正确,故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO42H2O(分子量为M)中Mo的物质的量为![]() mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式
mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式![]() O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为
O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为![]() =
=![]() L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;
L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;![]() 。
。


科目:高中化学 来源: 题型:
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
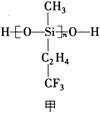
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。
(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
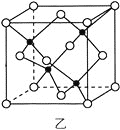
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)=2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
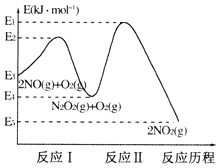
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)=2NO2(g)反应速率的是 _______(填“反应I”或“反应II”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
浓度/mol/L 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.040 | 0.030 | 0.030 |
20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为 ________ (保留两位有效数字)。
②在l0 min时,若只改变某一条件使平衡发生移动,20 min时重新达到平衡,则改变的条件是________
③在20 min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
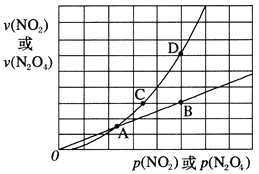
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
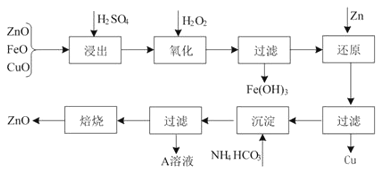
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
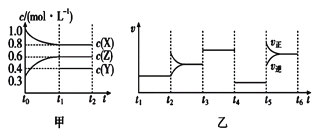
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C. 若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·L-1·s-1
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
①B能使湿润的红色石蕊试纸变蓝,A、C、D不能使湿润的石蕊试纸变色,E、G均可使湿润的蓝色石蕊试纸变红;
②F呈红棕色;
③G和H均能使品红褪色,A在H中安静燃烧并产生苍白色火焰;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属。
请回答下列问题:
(1)E的电子式为_____,D中所含元素的基态原子核外电子排布式为___,C分子中的σ键和π键的个数之比为___。
(2)写出实验室用固体药品制取B的化学方程式_______________。
(3)若从a口通入气体G,从b口通入气体F,X为氯化钡溶液,观察到的现象是_____________,
反应的离子方程式为_________________。

(4)已知:E(g)+3A(g)![]() CH3OH(l)+H2O(l) ΔH=-53.66 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-53.66 kJ·mol-1
2CH3OH(l)![]() CH3OCH3(g)+H2O(l) ΔH=-23.4 kJ·mol-1
CH3OCH3(g)+H2O(l) ΔH=-23.4 kJ·mol-1
写出E有催化剂时与A合成二甲醚(CH3OCH3)的热化学方程式_____________。
(5)气体C能使硫酸酸化的高锰酸钾溶液褪色,产物之一是E,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用青铜器的国家,后母戊鼎是我国的一级文物,是世界上出土的最大最重的青铜礼器。现代社会中铜的应用常广泛,铜的回收再利用是化工生产的一个重要领域。实验室利用废旧电池的铜帽![]() 、Zn总含量约为
、Zn总含量约为![]() 回收Cu并制备ZnO的部分实验过程如下:
回收Cu并制备ZnO的部分实验过程如下:

请回答下列问题:
(1)请写出一种加快铜帽溶解的方法:______。铜帽溶解时通入空气的作用是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(2)调节溶液pH时,是将溶液的pH调______![]() 填“大”或“小”
填“大”或“小”![]() 到
到![]() 。
。
(3)电解精炼粗铜时,阴极的电极反应式为______。工业上常釆用甲醇燃料电池作为电解精炼铜旳电源,写岀碱性甲醇燃料电池的负极反应式:______。
(4)已知:![]() 吋,
吋,![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 。室温下,几种离子生成氢氧化物沉淀的pH如下表所小
。室温下,几种离子生成氢氧化物沉淀的pH如下表所小![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() :
:
|
|
|
| |
开始沉淀的pH | 2 |
|
|
|
沉淀完全的pH |
|
|
|
①表中![]() 沉淀完全的pH为______。
沉淀完全的pH为______。
②由过滤粗铜的滤液制备ZnO的实验步骤依次为![]() 可选用的试剂:
可选用的试剂:![]() 、稀硝酸、
、稀硝酸、![]() 溶液
溶液![]() :
:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
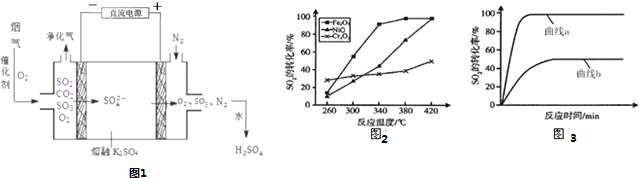
【题目】煤燃烧排放的烟气中![]() 主要含
主要含![]() 、
、![]() 的
的![]() 形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
(1)采用![]() 烟气脱硫可得到较好的效果.已知下列反应:
烟气脱硫可得到较好的效果.已知下列反应:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]()
![]()
![]()
![]() 的
的![]() ______ .
______ .
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的![]() 与
与![]() 溶于水所得溶液中
溶于水所得溶液中![]() ______
______ ![]() 填字母编号
填字母编号![]() .
.
A.![]() /span>
/span>![]()
C.![]()
![]()
(3)烟气在较高温度经如图1方法脱除![]() ,并制得
,并制得![]() .
.
①在阴极放电的物质是 ______ .
②在阳极生成![]() 的电极反应式是 ______ .
的电极反应式是 ______ .
③已知室温下,![]() 将脱除
将脱除![]() 后制得的
后制得的![]() 配成
配成![]() 的
的![]() 溶液,与
溶液,与![]() 的
的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() ,则
,则![]() 溶液与
溶液与![]() 溶液的体积比为 ______
溶液的体积比为 ______ ![]() 欲使溶液中
欲使溶液中![]() ,则应保持溶液中
,则应保持溶液中![]() ______
______ ![]() .
.
(4)一定条件下,用![]() 、NiO或
、NiO或![]() 作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:![]()
![]() 其他条件相同、催化剂不同时,
其他条件相同、催化剂不同时,![]() 的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理
的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理![]() 选填序号
选填序号![]() ;
;
![]()
![]()
![]()
选择该催化剂的理由是: ______ .
某科研小组用选择的催化剂,在![]() 时,研究了
时,研究了![]() :
:![]() 分别为1:1、3:1时,
分别为1:1、3:1时,![]() 转化率的变化情况
转化率的变化情况![]() 图
图![]() 则图3中表示
则图3中表示![]() :
:![]() :1的变化曲线为 ______ .
:1的变化曲线为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
B.将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
C.![]() 溶液中加入
溶液中加入![]() 溶液使
溶液使![]() 完全沉淀:
完全沉淀:![]()
D.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:
充分反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com