
【题目】常温下,将NaOH固体分别加入浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
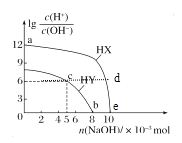
A.由a点到e点水的电离程度先增大后减小
B.d点溶液中存在:c(HX)+c(X-)=0.1mol/L
C.c点溶液中存在:c(Y-)+2c(OH-)=2c(H+)+c(HY)
D.b点溶液中存在:c(HY)+c(Na+)=0.1mol/L
【答案】CD
【解析】
A. a点lg![]() =12,则溶液中c(H+)=0.1mol/L,可知HX为强酸,e点lg
=12,则溶液中c(H+)=0.1mol/L,可知HX为强酸,e点lg![]() =0,则溶液中c(H+)=10-7mol/L完全中和,强酸对水的电离起抑制作用,酸的浓度减小,则水的电离变大,由a点到e点水的电离程度一直增大,A项错误;
=0,则溶液中c(H+)=10-7mol/L完全中和,强酸对水的电离起抑制作用,酸的浓度减小,则水的电离变大,由a点到e点水的电离程度一直增大,A项错误;
B. HX为强酸会完全电离,溶液中不存在HX,B项错误;
C. c点lg![]() =6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),根据元素守恒有c(Y-)+c(HY)=2c(Na+),联立两个等式可得c(Y-)+2c(OH-)=2c(H+)+c(HY),所以c(Y-)+2c(OH-)=2c(H+)+c(HY),C项正确;
=6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),根据元素守恒有c(Y-)+c(HY)=2c(Na+),联立两个等式可得c(Y-)+2c(OH-)=2c(H+)+c(HY),所以c(Y-)+2c(OH-)=2c(H+)+c(HY),C项正确;
D. b点lg![]() =0,则溶液中c(H+)=10-7mol/L= c(OH-),根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),即c(Y-) = c(Na+),根据元素守恒有c(Y-)+c(HY)=0.1mol/L,联立两个等式可得c(HY)+c(Na+)=0.1mol/L,所以c(HY)+c(Na+)=0.1mol/L,D项正确;
=0,则溶液中c(H+)=10-7mol/L= c(OH-),根据电荷守恒有c(Y-)+c(OH-)=c(H+)+ c(Na+),即c(Y-) = c(Na+),根据元素守恒有c(Y-)+c(HY)=0.1mol/L,联立两个等式可得c(HY)+c(Na+)=0.1mol/L,所以c(HY)+c(Na+)=0.1mol/L,D项正确;
答案选CD。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】信息时代产生的电子垃圾处理不当会对环境构成威胁。某研究小组将废弃的线路板处理后,得到含Cu、Al及少量Fe的金属混合物,并设计如下流程制备硫酸铜和硫酸铝晶体。

请回答:
(1)步骤①~③所涉及的实验操作方法中,属于过滤的是______(填序号)。
(2)步骤①中Cu、Al、Fe均能与稀硫酸和浓硝酸的混合物在加热条件下反应,其中氮元素全部转化为NO。该步骤中稀硫酸的作用是______。
(3)下列关于步骤②的说法正确的是______(填字母)。
a 沉淀B为白色固体
b H2O2的作用是将Fe2+氧化为Fe3+
c 可以用Ba(OH)2溶液替换NaOH溶液
(4)已知AlO2-+ 4H+=Al3+ + 2H2O。由沉淀B制取Al2(SO4)3·18H2O的操作是:将沉淀B转移到烧杯中,______,将溶液加热蒸发、冷却结晶、过滤得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管中进行下列实验,现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向硫酸铜水溶液中逐滴加入氨水 | 先产生蓝色沉淀,然后溶解,最后得到深蓝色透明溶液 |
B | 向I2的CCl4溶液中加入浓KI溶液,振荡 | 溶液紫红色变浅 |
C | 向橙色的K2Cr2O7溶液中加入10滴浓硫酸,振荡 | 溶液由橙色变为黄色 |
D | 向饱和硼酸溶液中加入Na2CO3溶液 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的有机产物,肯定是一种的是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH溶液共热发生反应
)与NaOH溶液共热发生反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 等物质的量的甲烷和氯气的混和气体长时间光照后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从腐败草中提取出一种能使血液不凝固的双豆香素M,M的结构简式如图所示。下列说法正确的是( )
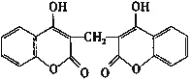
A.M能使溴水、酸性高锰酸钾溶液褪色,其褪色原理相同
B.M分子中所有原子可能处于同一平面
C.M分子中苯环上的一氯代物有4种
D.M分子有3种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气是气体和烟尘的混合物,是污染居民区大气的主要原因,气体中的污染气体主要是 SO2 及氮氧化合物等。
Ⅰ.某实验小组模拟湿式石灰/石灰法空气脱硫,他们主要是使用石灰石(CaCO3)浆液作洗涤剂,对烟气进行洗涤,从而除去烟气中的SO2。
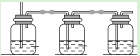
(1)上图是实验小组设计的装置图的一部分,三个装置中均盛放石灰浆液,这样设计的目的是________________。在所得的产物中通入臭氧可得生石膏,写出反应的方程式_________________________。
(2)二氧化硫通入氯化钡溶液中不产生沉淀,通入另一种气体A后可以产生白色沉淀,则下列哪组试剂产生的气体符合A的要求___________。
A.大理石和盐酸 B. 氧化钙和浓氨水 C. 铜和浓硝酸 D. 高锰酸钾和浓盐酸
(3)为了测定烟气中二氧化硫的含量,他们设计了下列方案:先将含二氧化硫的aL烟气用氯水氧化,再用沉淀剂氯化钡获得沉淀,最终获得bg沉淀。在称量沉淀前应对沉淀进行洗涤,如何证明沉淀洗涤干净______________________________________________。烟气中二氧化硫的浓度为_________g/L。
Ⅱ. 某烟气研究组采用尿素H2N(CO)NH2,溶液在50~70℃时进行脱硫脱硝,装置如图所示。
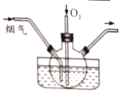
(1)如果不通入氧气,发现只有少量的烟气被吸收,生成对环境友好的物质。 被吸收的气体为___________ ;发生反应的化学方程式为_________________________。
(2) 如果通入烟气和一定量氧气的混合气,氮氧化物的吸收率仍然较低,可能的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法正确的是( )

A.m=2
B.在Xm-中,硼原子轨道的杂化类型相同
C.1、2原子间和4、5原子间的化学键可能是配位键
D.Xm-中含离子键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2(SO4)3溶液中加入KSCN溶液,发生反应:Fe3++SCN-[Fe(SCN)]2+;若加入K4[Fe(CN)6]溶液,两者发生反应会生成Fe4[Fe(CN)6]3沉淀。
(1)基态Fe原子的价电子排布式为_______,Fe原子失去电子变成阳离子时,首先失去的电子所处的轨道的形状为_______
(2)[Fe(SCN)]2+的四种元素中第一电离能最大的是_______ (填元素符号,下同),电负性最大的是_______。
(3)配合物Fe(CO)n可作催化剂,Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n =_______
(4)Fe4[Fe(CN)6]3中铁元素的化合价为_______。
(5)SO42-的立体构型为_______。
(6)铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg),铁镁合金的化学式为_______;若该晶胞为正方体,棱长为a cm,则镁原子与铁原子间的最短距离为_______cm,晶胞的密度为_______gcm-3。
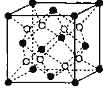
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
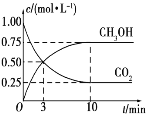
A.升高温度能使![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com