
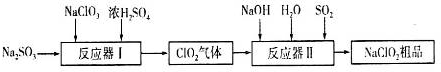
分析 根据题中流程,发生器中NaClO3在酸性条件下被还原成ClO2,在吸收塔中ClO2在碱性条件下被二氧化硫还原成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2.
(1)根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸、Na2SO3,生成物有ClO2气体根据反应物和生成物的化合价的变化,有元素化合价降低的反应物为氧化剂;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,书写出氧化还原反应方程式:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2;
(4)根据反应:ClO2-+4I-+4H+=Cl-+2I2+2H2O,以及2Na2S2O3+I2═Na2S4O6+2NaI,可得反应的关系式:ClO2-~2I2~4Na2S2O3,根据关系式计算.
解答 解:(1)根据加入到反应器Ⅰ中的原料有NaClO3、浓硫酸、Na2SO3,生成物有ClO2气体,依据书写化学方程式的规则,即发生化学反应时满足原子的种类和数目不变,书写出化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,Cl的化合价(+5→+4),NaClO3为氧化剂,
故答案为:NaClO3;
(2)根据通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,氯的化合价由+4价变成了+3价,得到电子,根据氧化还原反应的原理硫应失电子,由+4价变成+6价,根据氧化还原反应原理的氧化剂得到电子总数等于还原剂失去电子的总数,则氧化还原反应方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)如果将反应器Ⅱ中的SO2 用H2O2 代替同样能生成NaClO2,说明变换物质后,氧化还原反应照样能发生生成NaClO2,也就说明H2O2也具有还原性,也能把ClO2还原为
NaClO2,
故答案为:H2O2有还原性也能把ClO2还原为NaClO2;
(4)取上述合成产品10g溶于水配成1L溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,发生ClO2-+4I-+4H+=Cl-+2I2+2H2O,充分反应后加入2~3滴淀粉溶液,溶液变蓝,用0.20mol/L Na2S2O3标准液滴定,发生:2Na2S2O3+I2═Na2S4O6+2NaI,蓝色变为无色,
可得反应的关系式为:ClO2-~2I2~4Na2S2O3,又n(Na2S2O3)=0.20mol/L×0.02L=0.004mol,
则ClO2-~2I2~4Na2S2O3
1 4
n(ClO2-) 0.004mol n(ClO2-)=0.001mol,所以1L溶液中含有:n(NaClO2)=0.001mol×100=0.1mol,
则10g合成产品中含有:m(NaClO2)=0.1mol×90.5g/mol=0.905g,NaClO2粗品的纯度为$\frac{0.905g}{10g}$×100%=90.5%,
故答案为:90.5%.
点评 本题是一道化工生产制备NaClO2的工艺流程,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热灼烧海带时要在蒸发皿中进行 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液一定含有Cl- | |
| D. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
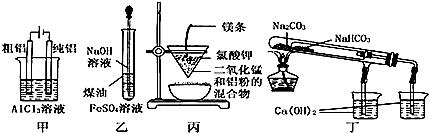
| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
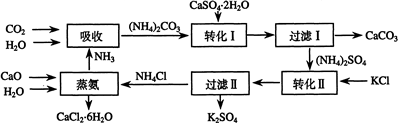
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X->Y- | |
| B. | 在X-、Y-、Z-、W- 中 Z- 的还原性最强 | |
| C. | 氧化性:Z2>W2 | |
| D. | 反应2Z-+Y2=2Y-+Z2可以发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com