
已知两个热化学方程式:C(s)+O2(g)==CO2(g) △H= ―393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H= ―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
科目:高中化学 来源: 题型:
将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是( )
A.v(C)=0.2 mol/(L·min)
B.z=3
C.B的转化率为25%
D.C的体积分数为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
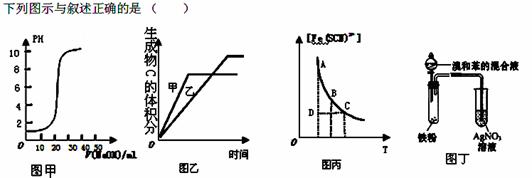
A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大
3C (g)+D (s)的影响且甲的比乙的压强大
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度
Fe(SCN)2+(aq)平衡时,物质的量浓度
[Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆)
D.图丁所示装置可证明溴与苯发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气)  3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
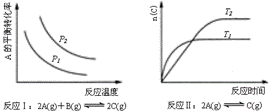

根据以上规律判断,上列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H>0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g) ① ;
4PH3(g) P4(g)+ 6 H2(g) ② ;
2HI(g) H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.非金属氧化物均属于酸性氧化物
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.根据电解质的水溶液导电性的强弱,将电解质分为强电解质和弱电解质
D.根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,会发生如下反应(未配平):Mn2++S2O +H2O―→MnO
+H2O―→MnO +SO
+SO +H+。下列说法正确的是( )
+H+。下列说法正确的是( )
A.该反应中起氧化作用的是Mn2+
B.反应中有1 mol还原剂参加反应时,转移的电子物质的量为4 mol
C.反应后溶液的pH降低
D.该反应常用于检验溶液中Mn2+的存在,现象是溶液紫红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法正确的是( )
2PbSO4(s)+2H2O(l),下列说法正确的是( )
A.放电时,负极的电极反应式为:Pb-2e-===Pb2+
B.放电时 ,正极得电子的物质是PbO2
,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为PbSO4-2e-+2H2O===PbO2+4H++SO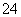
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com