
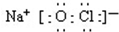 .
.分析 (1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,以此可确定在周期表中的位置;
(2)根据次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,电离平衡常数K=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$,依据水解平衡常数和溶液中离子积常数计算,洁厕液与84消毒液混合后会生成有毒的氯气,是洁厕净中盐酸和84消毒液中氯离子、次氯酸根离子发生氧化还原反应生成氯气;
(4)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,结合电荷守恒和原子守恒配平书写离子方程式;
②选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.
解答 解:(1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族,
故答案为:第三周期ⅦA 族;
(2 )次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为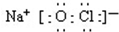 ,
,
故答案为: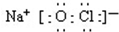 ;
;
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,常温下,0.1mol/L的NaClO溶液的pH=9.7,ClO-+H2O?HClO+OH-,Kh=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$=$\frac{Kw}{Ka}$,则Ka=$\frac{1{0}^{-14}}{0.1×1{0}^{-4.3}}$═10-6.4,
次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-;10-6.4;ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①在碱性条件下,NaClO氧化硝酸铁制得Na2FeO4,利用化合价升降法配平,该反应的离子反应方程式为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
②K2FeO4 在水溶液中水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤,
a.H2O不能抑制水解,容易损失,故a错误;
b.NH4Cl、异丙醇,促进水解,故b错误;
c.Fe(NO3)3、异丙醇,促进水解,个c错误;
d. CH3COONa、异丙醇,能抑制水解,减少洗涤损失,故d正确,故选d,
故答案为:d.
点评 本题考查较综合,侧重于学生的分析能力及应用能力的考查,为高考常见题型,注意把握物质的性质、盐类水解及氧化还原反应为解答该类题目的关键,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
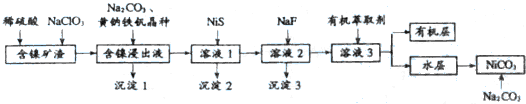
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 将钢闸门与电源正极相连,可防止其在海水中被腐蚀 | |
| D. | 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol/LH2SO4 | 若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO |
| C | 淀粉碘化钾溶液久置显蓝色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 向含有少量的FeBr3的FeCl3溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl3溶液中的FeBr3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③ | C. | 只有③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com