
����Ŀ�������º�̼����H2CO3��HCO3����CO32��������CO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�����������ҺpH�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ������� 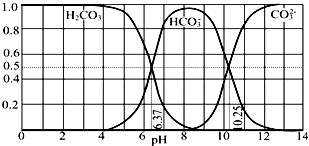
A.pH=10.25ʱ��c��Na+���Tc��CO32����+c��HCO3����
B.Ϊ��þ����ܴ���NaHCO3 �� �˿�����Һ��pHΪ7��9֮��
C.����ͼ�����ݣ����Լ���õ�H2CO3��һ�������ƽ�ⳣ��K1��H2CO3��=10��6.37
D.����0.1mol NaOH ��Ӧ�����õ�1L��Һ��pH=10ʱ����Һ�д������¹�ϵ��c��Na+����c��HCO3������c��CO32������c��OH������c��H+��
���𰸡�A
��������A������ͼʾ��֪��pH=10.25ʱ����Ϊ̼���ƺ�̼�����ƣ����������غ��жϣ�
B������ͼʾ��֪��pH��7��9֮����Ҫ����̼��������ӣ�
C������pH=6.37ʱ̼��������Ӻ�̼���Ũ����ȼ��㣻
D��pH=10ʱ��Һ�ʼ��ԣ���c��OH������c��H+����c��Na+������Ũ������ͼ�����߱仯���ж�c��HCO3������c��CO32�����Ĵ�С��
�⣺A��pH=10.25ʱ������Ϊ̼���ƺ�̼�����ƣ�̼������Һ�����������غ㣺c��Na+���T2c��CO32����+2c��HCO3����+2c��H2CO3����̼��������Һ�д��������غ㣺c��Na+��=c��CO32����+c��HCO3����+c��H2CO3��������Һ��c��Na+����c��CO32����+c��HCO3��������A����
B������ͼʾ��֪��pH��7��9֮�䣬��Һ����Ҫ����HCO3������pH��Χ�ںͻ�ýϴ���NaHCO3����B��ȷ��
C������ͼ�����߿�֪��pH=6.37ʱ��H2CO3��HCO3����Ũ����ȣ�̼��ĵ�һ�������ƽ�ⳣ��K1��H2CO3��= ![]() =10��6.37����C��ȷ��
=10��6.37����C��ȷ��
D��pH=10ʱ����ҺΪ���ԣ���c��OH������c��H+��������Ϊ̼���ƺ�̼�����ƣ�c��Na+������Ũ������ͼ�����߱仯��֪��c��HCO3������c��CO32��������ʱ����Ũ�ȴ�СΪ��c��Na+����c��HCO3������c��CO32������c��OH������c��H+������D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����ù���������ͭ���мĩ����������ʵ�飺 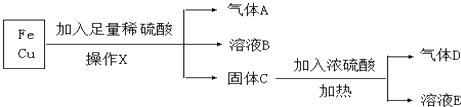
��1������X����������
��2������D����
��3��A������ͭ���ȷ�Ӧ����ͭ��ˮ����Ӧ�й������ɫ�仯����A���������������ԭ��������
��4����ҺB�еĽ����������� �� ��ҺE�������ӳ���OH����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�(CH3NH2)��һ��Ӧ�ù㷺��һԪ��������£���200mL0.10mol/L�ļװ���Һ�еμ�V mL.0.10mol/L��ϡ���ᣬ�����Һ��pH�������Ũ�ȵĹ�ϵ��ͼ��ʾ������˵���д������
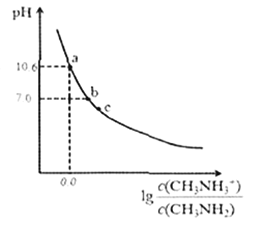
A. b���Ӧ������������V< 20.00mL
B. �װ���ˮ�еĵ��뷽��ʽΪ:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. ���������װ��ĵ��볣��ΪKb����pKb=-1gKb=4.3
D. c����ܴ��ڹ�ϵ: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��λΪ��Ӫ��������գ�����Ƭ��ϡ����������������������д�ʩ����ʹ�÷�Ӧ�����������( )
A.��������NaHSO4����B.ϡ�����ΪŨ����
C.����D.����Ƭѹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽ��ֳ����л���֮���ת����ϵͼ��C���й���ζ��

����������Ϣ�������ʵ�ת����ϵ������и���:
(1)A�Ľṹ��ʽΪ_______����ҵ������ϩ����A�Ļ�ѧ����ʽΪ__________��
(2)B�Ĺ���������Ϊ_____��B���봿����Һ��Ӧ��д���÷�Ӧ����ʽ_____________��
(3)A+B��C�Ļ�ѧ����ʽΪ__________����Ӧ����Ϊ_________��Ӧ��
(4)����˵����ȷ����_______��
a.�����л�����ֻ��C6H12O6������������
b.����A��B�����ڵ����
c.����C����֬�����ʻ�Ϊͬϵ��
d.ת��1������������ɣ��ô������ڵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
(1)��ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪: 800��ʱ
��Ӧ��:2H2(g)+CO(g)![]() CH3OH(g) ��H=-90.8 kJ/mol
CH3OH(g) ��H=-90.8 kJ/mol
��Ӧ��:H2(g)+CO2(g)![]() H2O(g)+CO(g) ��H=+41.2kJ/mol
H2O(g)+CO(g) ��H=+41.2kJ/mol
(1)д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ___________________________________��
(2)���ڷ�Ӧ�٣������һ�����ܱ������а����ʵ���֮��1:2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ���ݴ��ж�
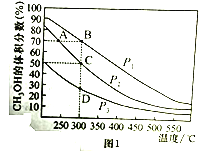
��ѹǿP1_____P2(�>����<����=������ͬ)
��ƽ�ⳣ��K(״̬C)_____K(״̬D)
�۷�Ӧ����:V��(״̬A)_____V��(״̬B)
(3)���ڷ�Ӧ�ڣ������һ�����ܱ������м���һ������H2��CO�����з�Ӧ������˵����ȷ����______��
A.���÷�Ӧ�ں��ݣ����ȵ������н��У���������ѹǿ���ֲ���ʱ������Ӧ�ﵽƽ��״̬
B.�÷�Ӧ�ﵽƽ��ʱ����ƽ����ϵ�г���һ�����ĺ�����ƽ����ܷ����ƶ�
C.���º��������£����ı䷴Ӧ���Ͷ��������H��ֵ�������仯
D.���º��������£���Ͷ��������������ֲ��䣬����ʼͶ�ϱ�[n(H2)/n(CO2)]=X����X=2��1/2ʱ��H2O������������䡣
(4)���ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2������������ʱ���ڲ�ͬ����(I��II��III)�����£�CH4���������ʱ��ı仯����ͼ2��ʾ����0-15h�ڣ��Է�Ӧ��Ч����õĴ�����____________(�����)��
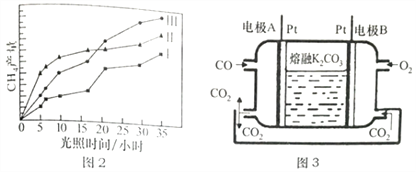
(5)һ������COȼ�ϵ�ع���ԭ������ͼ3��ʾ���õ�ظ����缫��ӦʽΪ______________���缫A��������CO2�в��ֲ���ѭ�����ã���������Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)����(Te)ΪVIA��Ԫ�أ��ǵ�����¼����²��ϵ���Ҫ�ɷ�֮һ����⾫��ͭ����������Ҫ�ɷ�ΪCu2Te��Ag2Se�������������ʼ������������ҵ�ϴ����л����ڡ�����һ�ֹ�����������:

��֪:
I.Se ����������ˮ��TeO2����ˮ�������ڽ�Ũ��ǿ���ǿ�
II.Ԫ��������Һ����Ҫ��Te4+��TeO32-��HTeO3-����ʽ���ڣ�
III.25��ʱ��������(H2TeO3)��Ka1=1��10-3��Ka2=2��10-8��
(1)Se���⻯��ĵ���ʽ��_______________��0.1mol/L��H2TeO3�����(�������������Һ��ﵽ����ƽ��ʱ����Һ���Ѿ�����ĵ���ʷ�����ռԭ���ܷ������İٷ������������) ԼΪ_____________________��
(2) ����Ũ���ᱺ��ǰ�����������д������ȷ��飬��Ŀ����_______________________��
(3) SeO2 ��SO2����ȴ��ͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽ_________________________________����Ӧ������Se���ʵIJ�����Ϊ_________________(���������)��
(4)��ɰ������TeO2��ʽ���ڣ�������NaOH��Һ��Ӧ��õ�����Һ�٣������ʵ���Ҫ�ɷ�Ϊ_______(�ѧʽ��������NaOH����)����ҵ��Ҳ����ͨ�������Һ�ٵõ������ڡ���֪���ʱ�ĵ缫��Ϊʯī���������ĵ缫��ӦʽΪ__________________________________��
(5)����Һ���м�������ʱ������Һ��pH Ϊ4.5~5.0������TeO2���������H2SO4�������������ڵĻ�����__________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
(6)��������TeO2����������õ����Ȼ��ڣ�Ȼ���ٽ�SO2ͨ�뵽��Һ�еõ�Te���ʣ���д�������Ȼ��ڵõ�Te���ʵ����ӷ���ʽ________________________________��
(7)���������п�ѭ�����õ�����_______________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶�/�� | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10��14 | �� | 1��10��12 |
�Իش��������⣺
��1����25��t1��t2 �� ���1��10��14���������������=�������������жϵ������� ��
��2��25���£�ijNa2SO4��Һ��c��SO42����=5��10��4 molL��1 �� ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c ��Na+����c ��OH����= ��
��3��t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2= �� ����Һ�и������ӵ�Ũ���ɴ�С������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ҩѧ����������Ϊ��ű��ҩ�����صĵ�һ�������ٻ�2015��ŵ��������ѧ��ҽѧ���������غ�˫�������صĽṹ��ʽ��ͼ��ʾ������˵��������ǣ������� 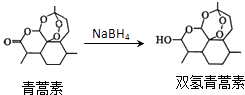
A.�����������ڱ���������ˮ
B.���������Ʊ�˫�������صķ�Ӧ���� ��ԭ��Ӧ
C.�����ؿ���NaOH��Һ��һ�������·���ˮ�ⷴӦ
D.˫�������ص�ͬ���칹�岻�����з����廯����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com