
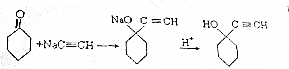
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| B. | 某元素一种同位素原子的质子数为m,中子数为n.则这种元素的相对原子质量为m+n | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 仅由两种元素形成的共价化合物中可以同时含有极性共价键和非极性共价键强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol•L-1HNO2溶液的pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
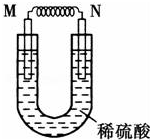 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,减少对化石能源的依赖 | |
| B. | 将燃煤进行脱硫处理,可减少酸雨的形成 | |
| C. | 雾霾(颗粒直径为2.5 x103 nm)具有丁达尔效应 | |
| D. | 推广使用电动汽车,可减少城市雾霾的形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com