
| A. | 64g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 0.5NA个O2的质量为32g | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
分析 A、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含2mol氧原子来分析;
B、溶液体积不明确;
C、质量m=$\frac{N}{{N}_{A}}M$;
D、求出氮气的物质的量,然后根据分子个数N=nNA来分析.
解答 解:A、64g二氧化硫的物质的量为1mol,而1mol二氧化硫中含2mol氧原子,即2NA个,故A错误;
B、溶液体积不明确,故溶液中氯离子的个数无法计算,故B错误;
C、质量m=$\frac{N}{{N}_{A}}M$=$\frac{0.5{N}_{A}}{{N}_{A}/mol}×32g/mol$=16g,故C错误;
D、14g氮气的物质的量为0.5mol,故分子个数N=nNA=0.5NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A.海水蒸馏得到淡水 | B.中和滴定 | C.苯萃取碘水中I2,分出水层后的操作 | D.制备乙酸乙酯 |
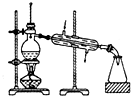 | 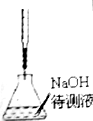 | 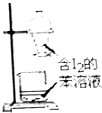 | 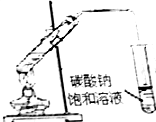 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H ++Cl -+ClO - | |
| B. | Na2CO3溶液中CO32的水解:CO32-+H2O═HCO32-+OH - | |
| C. | 酸性溶液中KIO3与KI反应生成I 2:IO3-+I -+6H +═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO32-+Ba2++OH -═BaCO3↓+H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | H2O既有氧化性又有还原性 | |
| D. | KMnO4是一种强氧化剂,没有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
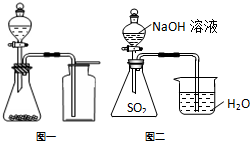
| A. | 氯气通入澄清石灰水中,制取漂白粉 | |
| B. | 可通过化合反应得到Fe(OH)3 | |
| C. | 选择合适的试剂,用图一所示装置可分别制取少量CO2、NO和O2 | |
| D. | 用图二的装置可证明SO2与NaOH发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
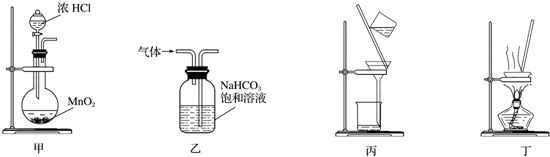
| A. | 用甲装置制取氯气 | B. | 用乙装置除去Cl2中的少量氯化氢 | ||
| C. | 粗盐的提纯过程中用到丙装置 | D. | 用丁装置蒸干溶液制取NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、5 | B. | 5、4 | C. | 3、4 | D. | 5、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液后过滤 | |
| C. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| D. | Na2O2粉末(Na2O),将混合物在空气中加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com