
����Ŀ�������£��õ�Ũ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1 mol/L��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������ж���ȷ����( )
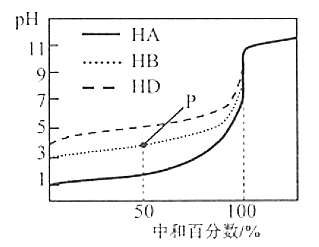
A.��Ũ�ȵ��������к͵�����NaOH��Ҫ������������V(HA)��V(HB)��V(HD)
B.�ӵζ���ʼ��pH=7ʱ��������Һ��ˮ�ĵ���̶�������
C.�ζ���P��ʱ����Һ�У�c(HB)+c(H+)=c(B-)+c(OH-)
D.���кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
���𰸡�B
��������
A�������ᶼ��һԪ�ᣬ����к�������ͬ���к͵����ʵ�����NaOH����������������ʵ���Ҳ��ȣ�����n=c![]() V�����������Ũ����ȣ�����������������Ҳ��ȣ����к͵�����NaOH��Ҫ������������ϵΪ��V(HA)=V(HB)=V(HD)��A����
V�����������Ũ����ȣ�����������������Ҳ��ȣ����к͵�����NaOH��Ҫ������������ϵΪ��V(HA)=V(HB)=V(HD)��A����
B������������Һ����μ���NaOH��Һ����Һ���������������ˮ�������������������ˮ����̶���������ǡ�ñ��кͲ�����ʱ��ˮ����̶ȴﵽ�������ҺpH=7ʱ�������ỹû����ȫ���кͣ����ˮ����̶�������B��ȷ��
C�����ݵ���غ�ɵâ٣�c(Na+)+c(H+)=c(OH-)+c(B-)��P��ʱ���ݺ������кͰٷ���Ϊ50%����֪c(NaB)��c(HB)=1��1����ʱ����Һ�����ԣ�c(H+)��c(OH-)����c(B-)��c(HB)�����������غ�ɵâڣ�2c(Na+)=c(B-)+c(HB)���١�2-�������ɵ�c(HB)+2c(H+)=c(B-)+2c(OH-)������c(H+)>c(OH-)������c(HB)+c(H+)��c(B-)+c(OH-)��C����
D������ͼʾ��֪��0.1 mol/L����HA��pH=1��c(H+)=0.1 mol/L=c(HA)��˵��HA��һԪǿ�ᣬ�кͰٷ����ﵽ100%�������Һ��c(NaA)=c(NaB)=c(NaD)��NaA��ǿ��ǿ���Σ���ˮ�⣻��HB��HD��c(H+)С�����Ũ�ȣ�֤��HB��HD�����ᣬ����Һ����NaB��NaDˮ��ʹ��Һ�Լ��ԣ����������غ�ɵã�c(OH-)=c(HB)+c(HD)+c(H+)������c(HB)+c(HD)=c(OH-)-c(H+)������c(HA)+c(HB)+c(HD)��c(OH-)-c(H+)��D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I�Ǻϳ���Ԫ����������һ���м��塣�ϳ�I��·����ͼ��
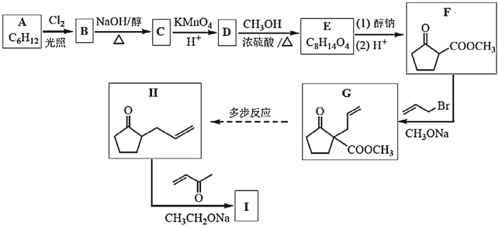
��֪����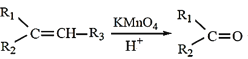 +R3COOH(��R1����R2����R3��Ϊ����)
+R3COOH(��R1����R2����R3������)
��![]()
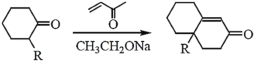
��
�ش��������⣺
��1������H2��һ�������¼ӳɿɵ�A��A�Ľṹ��ʽ��___��
��2��BΪһ�ȴ��B��C�Ļ�ѧ����ʽ��___��
��3��D�еĹ�����������___��
��4��D��E�Ļ�ѧ����ʽ��___��
��5������˵����ȷ����__��
a.����F�ĺ˴Ź���������2�����շ壻
b.F��G�ķ�Ӧ����Ϊ�ӳ�
c.1mol����G�������ӳ�����������������ʵ���Ϊ2mol��
d.����H����˳���칹�壻
��6������I�Ľṹ��ʽ��___��
��7����д����BΪԭ�ϣ������Լ���ѡ���ϳ�![]() ��·��______��
��·��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷŵ�β���Ǵ�����Ⱦ����֮һ����μ�����Ⱦ������ŷ��ǿ�ѧ���о������ſ��⡣��ش��������⣺
(1)��֪��CO��ȼ����Ϊ283.0kJ��mol-1��N2(g)+2O2(g)![]() 2NO2(g) ��H= +64kJ��mol-1����NO2(g)+2CO(g)=
2NO2(g) ��H= +64kJ��mol-1����NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ��H=____kJ��mol-1�����÷�Ӧ����14g��ԭ��������Ӧ����ת�Ƶ���___mol��
N2(g)+2CO2(g) ��H=____kJ��mol-1�����÷�Ӧ����14g��ԭ��������Ӧ����ת�Ƶ���___mol��
(2)ʹ�����ŷŵ�CO��NO��һ�������·�����Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)������Ч�ؼ��ٿ�����Ⱦ������һ���¶��£���6mol NO��8mol CO����10L�̶��ݻ��������з���������Ӧ����Ӧ�����и����ʵ�Ũ�ȱ仯��ͼ1��ʾ��
N2(g)+2CO2(g)������Ч�ؼ��ٿ�����Ⱦ������һ���¶��£���6mol NO��8mol CO����10L�̶��ݻ��������з���������Ӧ����Ӧ�����и����ʵ�Ũ�ȱ仯��ͼ1��ʾ��
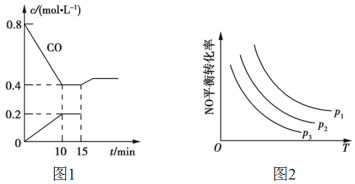
�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ��K=___��NO��ƽ��ת����=____��
��15minʱ�����ı䷴Ӧ����������COŨ�ȷ�����ͼ1��ʾ�ı仯����ı������������___(����)��
a.��С������� b.����CO2���� c.�������ͨ��������� d.�������
�۵�NO��CO����ʼŨ�����ʱ����ϵ��NO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��������˵����ȷ����____ (����)��
A���÷�Ӧ��H<0
B��p1<p2<p3
C�������¶�����Ӧ���ʼ�С���淴Ӧ��������
D���¶Ȳ��䣬����ѹǿ��ƽ�ⳣ������
������˵�������жϷ�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�ﵽƽ�����____(����)��
N2(g)+2CO2(g)�ﵽƽ�����____(����)��
A����Ӧ�������������ʵ������
B����λʱ��������1mol NOͬʱ����1mol CO2
C���������ѹǿ���ٷ����仯
D��NO��Ũ�Ȳ��ٱ仯
����Ӧ�������ٷֱ�����������壬��ʹNOת�����������____(����)��
A��O2 B��N2 C��CO D��NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����![]() ��Һ��ԭ����ͼ��ʾ������˵����ȷ����( )
��Һ��ԭ����ͼ��ʾ������˵����ȷ����( )
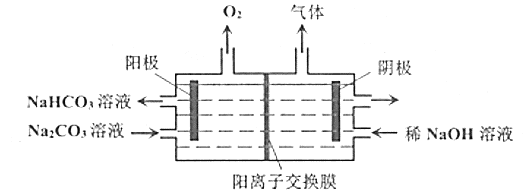
A.���ŵ��Ľ��У���������Һ��pH��С
B.![]() ��������������Ĥ�������ƶ�
��������������Ĥ�������ƶ�
C.�����ÿ��淴Ӧԭ������˵��װ�õĵ�Դ����ԭ����з����ķ�Ӧ��ƽ��ʱ���õ��װ�ò���ֹͣ����
D.�����缫��Ӧʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��FeCl3+3KSCN![]() Fe(SCN)3+3KCl�����ӷ���ʽΪ��Fe3++3SCN-
Fe(SCN)3+3KCl�����ӷ���ʽΪ��Fe3++3SCN-![]() Fe(SCN)3���ﵽƽ��������в�����ƽ�������ƶ���
Fe(SCN)3���ﵽƽ��������в�����ƽ�������ƶ���
(1)��������FeCl3���壺ƽ����____________�ƶ���
(2)��������KSCN���壺ƽ����____________�ƶ���
(3)��������KCl���壺ƽ��____________�ƶ�����������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ����̼��ˮ�����ķ�ӦΪ��CO(g)+H2O(g)![]() CO2(g)+H2(g)����427 ��ʱ��ƽ�ⳣ����9�������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.01 mol/ L������һ����̼�ڴ˷�Ӧ�����µ�ת����_____________��
CO2(g)+H2(g)����427 ��ʱ��ƽ�ⳣ����9�������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.01 mol/ L������һ����̼�ڴ˷�Ӧ�����µ�ת����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.01mol��L��1MOH��Һ��pHΪ10����֪��2MOH(aq)��H2SO4(aq)===M2SO4(aq)��2H2O(l)����H1����24.2 kJ��mol��1��H��(aq)��OH��(aq)===H2O(l)����H2����57.3 kJ��mol��1����MOH��ˮ��Һ�е���Ħ�HΪ(����)
A. ��33.1 kJ��mol��1 B. ��45.2 kJ��mol��1
C. ��81.5 kJ��mol��1 D. ��33.1 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п����ȼ�ϵ�ع㷺������·�������Ʊ��Լ��������У���װ��ʾ��ͼ��ͼ��ʾ������˵��������ǣ� ��
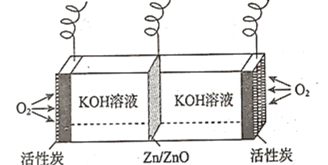
A.�ŵ�ʱ�������ĵ缫��ӦʽΪ![]()
B.�ŵ�ʱ��![]() �����̿�缫�����ƶ�
�����̿�缫�����ƶ�
C.���ʱ��![]() �缫�ϵĵ��ƱȻ���̿�缫�ϵĸ�
�缫�ϵĵ��ƱȻ���̿�缫�ϵĸ�
D.���ʱ����������С![]() ����������������
����������������![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
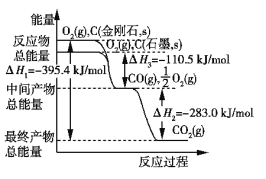
����Ŀ�����û�ѧ��Ӧԭ���о�̼������Ԫ�صĵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
��1����ͼ��ʾ���ʯ��ʯī����ط�Ӧ�����е������仯��ϵ��д��ʯīת��Ϊ���ʯ���Ȼ�ѧ����ʽ��____________________��
��2��CO��H2����һ�������·�Ӧ����ȼ�ϼ״���CO(g)+2H2(g)![]() CH3OH(g)����H��0����2 mol CO��4 mol H2����һ��������1 L�ܱ������У��ⶨ��ͬ��������ͬʱ�����CO��ת���ʣ��õ��±����ݡ�
CH3OH(g)����H��0����2 mol CO��4 mol H2����һ��������1 L�ܱ������У��ⶨ��ͬ��������ͬʱ�����CO��ת���ʣ��õ��±����ݡ�

���¶�ΪT1ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ____________��a1��a2��80%���ߵĴ�С��ϵΪ______________�������¶�ΪT1ʱ�����������������ж�����ȷ����__________��
A����Ӧ��2Сʱ��ʱ����������ܶȺ���Է�����������1Сʱ�Ĵ�
B����Ӧ��3Сʱ��ʱ��v��(H2)=2v��(CH3OH)
C���������������䣬�ٳ���6 mol H2�������ɵõ�64 g CH3OH
D�������������䣬����������H2Ϊ2.4 mol�����ƽ��ʱCO��ת����Ϊ50%
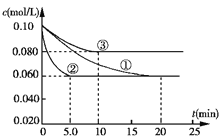
��3����ҵ�г������·�Ӧ�ϳɰ���N2(g)+3H2(g)![]() 2NH3(g)����H��0����������ͬ�������ܱ������м���N2��H2���з�Ӧ����ʼʱc(N2)��Ϊ0.10 mol/L��c(H2)��Ϊ0.30 mol/L��N2��Ũ����ʱ��ı仯��ͼ�١��ڡ���������ʾ��������в���NH3��0��10 min��ƽ����Ӧ���ʣ�_______��������ڢ�������ͬ���ڵ�������______��������___________________��
2NH3(g)����H��0����������ͬ�������ܱ������м���N2��H2���з�Ӧ����ʼʱc(N2)��Ϊ0.10 mol/L��c(H2)��Ϊ0.30 mol/L��N2��Ũ����ʱ��ı仯��ͼ�١��ڡ���������ʾ��������в���NH3��0��10 min��ƽ����Ӧ���ʣ�_______��������ڢ�������ͬ���ڵ�������______��������___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com