
 如图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图.
如图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图.分析 由能量变化图可知反应物总能量大于生成物总能量,为放热反应,从化学键的角度分析断裂1molH-H键和1molCl-Cl键吸收的总能量小于形成2molH-Cl键放出的总能量,以此解答该题.
解答 解:(1)由能量变化图可知反应物总能量大于生成物总能量,为放热反应,则1mol H2(g)和1mol Cl2(g)的总能量大于 2mol HCl(g)的能量,
故答案为:>;
(2)该反应为放热反应,则断裂1molH-H键和1molCl-Cl键吸收的总能量小于形成2molH-Cl键放出的总能量,
故答案为:放;断裂1molH-H键和1molCl-Cl键吸收的总能量小于形成2molH-Cl键放出的总能量.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力以及双基知识的运用,本题注意把握反应热与物质的总能量以及化学键的关系,难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁上镀锌的保护方法叫牺牲负极的正极保护法 | |
| B. | 相同条件下,轮船在海水中比在淡水中腐蚀慢 | |
| C. | 钢铁在潮湿的空气中会发生吸氧腐蚀,负极反应为Fe-3e-=Fe3+ | |
| D. | 水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此溶液中由水电离C(OH-)=1×10-12mol/L | |
| B. | 加入等体积PH=2 CH3COOH溶液后溶液呈中性 | |
| C. | 此溶液中C(OH-)=1×10-2mol/L | |
| D. | 加水稀释100后,溶液的PH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X的化学名称是间苯二酚 | |
| B. | 反应①、②、③均为取代反应 | |
| C. | Y能发生加成反应和水解反应 | |
| D. | 肾上腺素既能与强碱反应又能与强酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

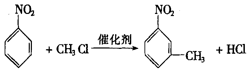 .
.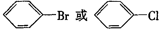 ,②
,② .
.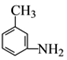 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水中加入少量MnO2,即可迅速放出气体 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 | |
| C. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C10H18O | |
| B. | 分子中有5个碳原子位于同一平面上 | |
| C. | 发生消去反应的有机产物只有一种 | |
| D. | 既能使Br2的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com