
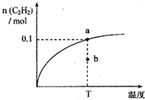
 温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
温度为T时,向2.00L恒容密闭容器中充入1.00molCH4,发生反应:2CH4(g)
| ||
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(CH4)/mol | 1.00 | 0.84 | 0.81 | 0.80 | 0.80 |
| A、温度T时,前5s H2平均速率为0.024mol?L-1?s-1 |
| B、温度T时,b点 υ(逆)>υ(正) |
| C、该反应的平衡常数随温度升高逐渐减小 |
| D、温度T时,若向2.00L恒容密闭充入2.00molC2H2和6.00molH2,达到平衡时,C2H2转化率大于80% |
| △c |
| △t |
| ||
| 5s |
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| 0.4 |
| 0.5 |


科目:高中化学 来源: 题型:
| A、③④ | B、②③④ |
| C、①③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
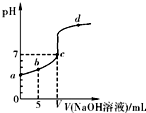 在25℃下,向10.00mL0.01mol?L-1某一元酸HA溶液中逐滴加入0,.01mol.L-1NaOH溶液,溶液pH变化曲线如图所示.下列说法正确的是( )
在25℃下,向10.00mL0.01mol?L-1某一元酸HA溶液中逐滴加入0,.01mol.L-1NaOH溶液,溶液pH变化曲线如图所示.下列说法正确的是( )| A、HA是强酸 |
| B、b点表示的溶液中:c(HA)=c(A-) |
| C、c点时:V=10.00mL |
| D、b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
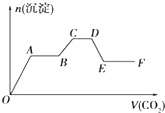 将CO2 气体缓缓通入到含有等物质的量的KOH、Ba(OH)2 和KAlO2 的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2 的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )
将CO2 气体缓缓通入到含有等物质的量的KOH、Ba(OH)2 和KAlO2 的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2 的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( )| A、A→B段与C→D段所发生的反应相同 |
| B、B→C段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
| C、O→A段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O |
| D、D→E段沉淀的减少是由于碳酸钡固体的消失所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业制H2SO4时,催化氧化阶段的反应原理为2SO2+O2
| ||||
B、海水提镁的主要步骤为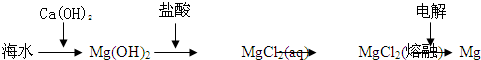 | ||||
C、冶炼铝时电解铝的反应原理为:2AlCl3
| ||||
D、高炉炼铁还原剂还原赤铁矿的化学方程式为:Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
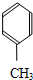 +CO
+CO| AlCl3、HCl |
| 加热 |
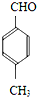
| CH3CHO |
| OH-、加热 |
| ①C |
| ②H+ |
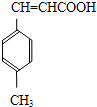
| CH3OH |
| H2SO4,加热 |
| OH-、加热 |
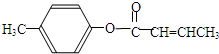 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
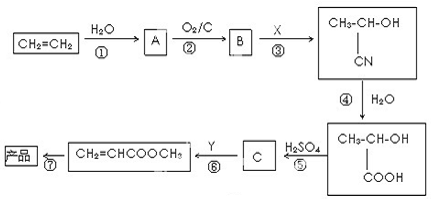
查看答案和解析>>
科目:高中化学 来源: 题型:
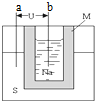 如图为钠硫高能电池的结构示意图,M为Na2O和Al2O3的混合物,电池反应为2Na+xS?Na2Sx该电池的工作温度为320℃左右,下列说法错误的是( )
如图为钠硫高能电池的结构示意图,M为Na2O和Al2O3的混合物,电池反应为2Na+xS?Na2Sx该电池的工作温度为320℃左右,下列说法错误的是( )| A、a为电池正极,b为电池负极 |
| B、电池放电时,正极反应为xS+2e-=Sx2- |
| C、电池充电时,Na所在电极连接电源正极 |
| D、M的作用为导电和隔离钠和硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
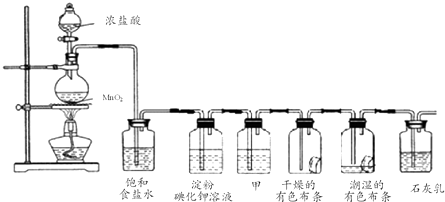
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com