
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:
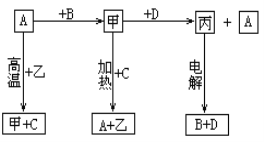
(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
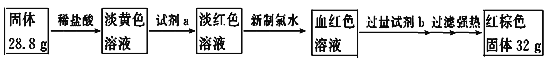
化合物甲的质量分数为________________。
【答案】 Fe3O4 Al2O3 3Fe3O4 +8Al ![]() 9Fe +4Al2O3 A、C、D 80.6%
9Fe +4Al2O3 A、C、D 80.6%
【解析】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价,则A是Fe,乙是H2O,甲是Fe3O4;B是O2,C是H2,D是Al,丙是Al2O3。(1) 甲的化学式为Fe3O4,丙的化学式为Al2O3;(2)甲和D在高温下发生铝热反应,产生Al2O3和Fe,反应的化学方程式是3Fe3O4 +8Al ![]() 9Fe +4Al2O3;(3)化合物甲是Fe3O4,要检验其中所含有的阳离子,要先用非氧化性的酸使其发生反应:Fe3O4+8H+= 2Fe3++Fe2+ +4H2O,然后在用高锰酸钾溶液检验Fe2+;用硫氰化钾溶液检验Fe3+,故使用的物质是A、C、D;(4)Fe与水蒸气反应产生Fe3O4,要测其含量,最后得到的红棕色的固体是Fe2O3,其物质的量是
9Fe +4Al2O3;(3)化合物甲是Fe3O4,要检验其中所含有的阳离子,要先用非氧化性的酸使其发生反应:Fe3O4+8H+= 2Fe3++Fe2+ +4H2O,然后在用高锰酸钾溶液检验Fe2+;用硫氰化钾溶液检验Fe3+,故使用的物质是A、C、D;(4)Fe与水蒸气反应产生Fe3O4,要测其含量,最后得到的红棕色的固体是Fe2O3,其物质的量是![]() ,n(Fe)=0.2mol×2=0.4mol,假设在28.8g中含有Fe、Fe3O4的物质的量分别是x、y,则x+3y=0.4mol,56x+232y=28.8g,解得x=0.1mol,y=0.1mol,所以化合物甲的质量分数为
,n(Fe)=0.2mol×2=0.4mol,假设在28.8g中含有Fe、Fe3O4的物质的量分别是x、y,则x+3y=0.4mol,56x+232y=28.8g,解得x=0.1mol,y=0.1mol,所以化合物甲的质量分数为![]()


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】我国科研工作者近期提出肉桂硫胺(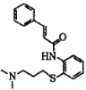 )可能对 2019- nCoV有疗效。肉桂硫胺的合成路线如图:
)可能对 2019- nCoV有疗效。肉桂硫胺的合成路线如图:

已知:
①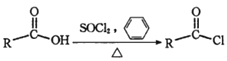
![]()

②R-NO2![]() R-NH2
R-NH2
完成下列问题
(1)F的结构简式为__________。G→H 的反应类型是____________。
(2)E中的所含官能团名称为______________。
(3)B→C反应试剂及条件为_______________ 。
(4)有机物 D 与新制氢氧化铜悬浊液(加热)的反应方程式为_________。
(5)J为 E的同分异构体,写出符合下列条件的J 的结构简式_______(写两种)。
①能发生银镜反应
②J 是芳香族化合物,且苯环上的一氯代物只有两种
③核磁共振氢谱有 5 组峰,且峰面积之比为 2 :2 :2 :1 :1
(6)参照上述合成路线及已知信息,写出由甲苯和丙酰氯(CH3CH2COCl) 为原料合成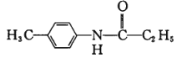 的路线:___________。
的路线:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
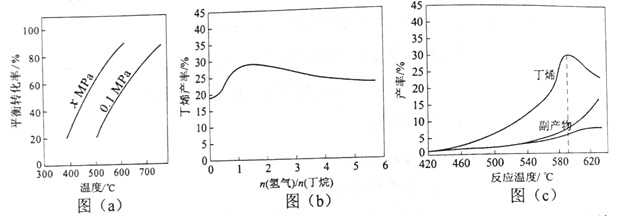
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,实验室制取高铁酸钠的化学方程式如下 :
(1)请用双线桥法表达出此反应的电子转移情况:__________
2Fe( NO3 )3+16NaOH+3Cl2=2Na2FeO4+6NaNO3 +6NaCl+8H2O
(2)若要制取8.3g高铁酸钠需要标准下Cl2的体积为多少?______若所用氢氧化钠溶液体积为200mL,则氢氧化钠溶液的物质的量浓度是多少?(写出计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是

A. 由甲可知:使用催化剂不影响反应热
B. 由乙可知:对于恒温恒容条件下的反应2NO2 (g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C. 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D. 由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.稀释氨水溶液 10 倍后,其 c(OH-)为原来的![]()
B.pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-)
C.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L
D.将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.元素的单质可由氧化或还原含该元素的化合物来制得
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A. 丙烷的二卤代物有4种,则其六卤代物是2种
B. 对二甲苯的一氯代物有3种
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种
D. 某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com