
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
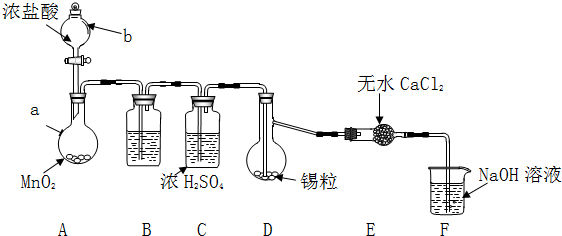
分析 Ⅱ.SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,B中盛放饱和食盐水除去HCl,可以降低氯气的溶解,C中浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在D反应生成SnCl4,未反应的氯气,用氢氧化钠溶液稀释,防止污染空气,干燥管中氯化钙吸收水蒸气,防止加入D中使产物水解.
(1)仪器b为分液漏斗;
(2)整个装置中充分氯气时,再加热熔化锡粒合成SnCl4;
(3)装置A中未反应完的MnO2与溶液不互溶,通过过滤进行分离回收;
Ⅲ.(1)F中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(2)SnCl4沸点低,在C得到主要为SnCl4蒸汽,应在D、E之间添加冷却收集装置进行收集;
(3)由于Sn2+易被Fe3+、O2等氧化,可以加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,根据颜色变化判断.
解答 解:Ⅱ.SnCl4极易水解,反应应在无水环境下进行进行,A中发生反应:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,B中盛放饱和食盐水除去HCl,可以降低氯气的溶解,C中浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在D反应生成SnCl4,未反应的氯气,用氢氧化钠溶液稀释,防止污染空气,干燥管中氯化钙吸收水蒸气,防止进入D中使产物水解.
(1)由仪器结构特征,可知仪器b为分液漏斗;由上述分析可知,无水CaCl2的作用是:吸收水蒸气,防止进入D中使SnCl4水解,B中的试剂是饱和NaCl溶液,
故答案为:分液漏斗;吸收水蒸气,防止进入D中使SnCl4水解;C;
(2)整个装置中充分氯气时,即充满黄绿色气体,再加热熔化锡粒合成SnCl4,
故答案为:充满黄绿色气体;
(3)装置A中未反应完的MnO2与溶液不互溶,经过过滤、洗涤、干燥进行分离回收,
故答案为:过滤;
Ⅲ.(1)F中氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(2)SnCl4沸点低,在C中得到主要为SnCl4蒸汽,应在D、E之间添加连有冷凝管的集气瓶,通入冷凝水冷却收集,
故答案为:连有冷凝管的集气瓶;
(3)由于Sn2+易被Fe3+、O2等氧化,加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,不出现红色,则含有SnCl2,否则无SnCl2,
故答案为:适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液.
点评 本题考查制备实验方案设计、对原理与装置的分析评价、物质检验方案设计等,注意阅读题目获取信息并迁移运用,难度中等.


科目:高中化学 来源: 题型:解答题
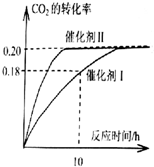 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
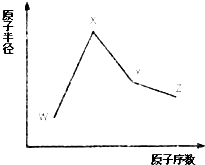 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.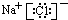 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
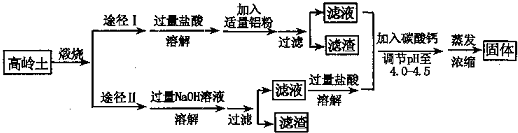
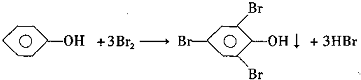
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com