
【题目】I.下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中元素I的价层电子排布图 。元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有( )
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)的配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
Ⅱ.(1) BCl3中B原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有 种。写出与BCl3结构相同的一种等电子体 (写离子)。
(2)科学家测得胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
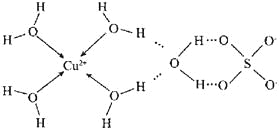
①胆矾的化学式用配合物的形式表示为的 ;
②胆矾中SO42-的空间构型为 。
【答案】I(1)![]() ;F>N>O>C (2)CD (3)BDF
;F>N>O>C (2)CD (3)BDF
(3)根据其性质可知应为分子晶体,晶体中存在范德华力,Cr(CO)5为配位化合物,其中含有配位键,CO中存在碳氧极性键。
Ⅱ.(1) sp23 NO3-或CO3 2-(2) ①[Cu(H2O)4SO4]·H2O ②正四面体
【解析】试题分析:根据元素在周期表中的位置知,从A~J分别是H、Be、C、N、O、F、Al、Cl、Cr、Fe元素;
(1)元素Cr的价层电子排布式为3d54s1,排布图如![]() ;同周期随核电荷数递增,第一电离能呈增大趋势,但因N原子的2p3轨道为半充满结构,相对稳定,元素C、N、O、F的第一电离能由大到小的顺序是F>N>O>C;
;同周期随核电荷数递增,第一电离能呈增大趋势,但因N原子的2p3轨道为半充满结构,相对稳定,元素C、N、O、F的第一电离能由大到小的顺序是F>N>O>C;
(2)元素H分别与C、N、O形成最简单的常见化合物分子CH4、NH3和H2O;A.CH4、NH3和H2O分子的空间构型分别为正四面体形、三角锥形、V形,故A正确;B.CH4、NH3和H2O分子中,中心原子均采取sp3的杂化方式,故B正确;C.CH4、NH3和H2O三种分子中键角由大到小的顺序是甲>乙>丙,故C错误;D.NH3和H2O分子均为由极性键构成的极性分子,CH4为极性键构成的非极性分子,故D错误;答案为CD。
(3)配位化合物为Fe(CO)5,该物质熔沸点低,易溶于非极性溶剂,属于分子晶体,分子之间存在范德华力,Fe与CO之间形成配位键,CO分子中含有极性键,故选BDF;
Ⅱ.(1)BCl3中的B原子的价层电子对数是3且不含孤电子对,所以B原子属于sp2杂化;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;BCl3互为等电子体的阴离子为:NO3-或CO3 2-;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子,所以其表示式为[Cu(H2O)4]SO4.H2O;
②胆矾中SO42-的价层电子对个数=4+×(6+2-4×2)=4,所以其空间构型正四面体结构。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】对于Zn(s) + H2SO4(aq) ═ ZnSO4(aq) + H2(g) △H=?的化学反应,下列叙述不正确的是 ( )

A、反应过程中能量关系如图所示,则该反应为放热反应
B、化学反应的反应热与反应方程式的计量数有关
C、若将该反应设计成原电池,锌为负极
D、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应。
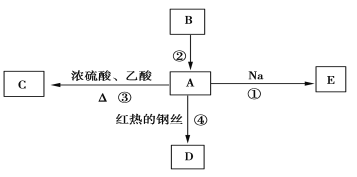
(1)写出A的化学式________。
(2)写出下列反应的化学方程式
反应①___________________________________________________________;
反应③_________________________________________________________;
反应④___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
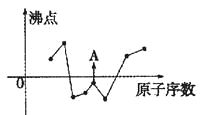
(2)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(3)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)很多金属盐都可以发生焰色反应,其原因是
(5) 已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
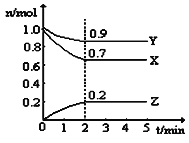
①该反应的化学方程式为__________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填“大”,“小”或“相等”,下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:
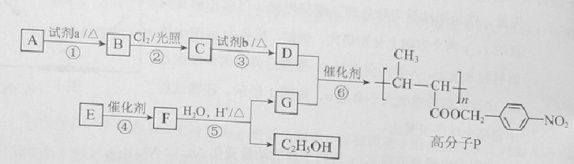
(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO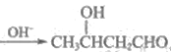 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() 【题目】通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。现准确称取一定量某烃样品,经燃烧后A管增重2.2 g, B管增重1.08g。请回答:
【题目】通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。现准确称取一定量某烃样品,经燃烧后A管增重2.2 g, B管增重1.08g。请回答:
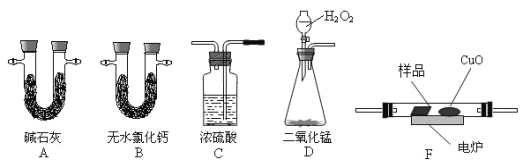
(1)按上述所给的测量信息,装置的连接顺序应是:D
(2)C管中浓硫酸的作用是
(3)该有机物在纯氧中充分燃烧的化学方程式为 (有机物用分子式表示)
(4)若该有机物分子中含有4个甲基,则该有机物的结构简式为_______________;该有机物的一氯代物有_________种,该有机物的二氯代物有_________种,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较: r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com