
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
分析 (1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)主族元素周期数=电子层数、主族族序数=最外层电子数,根据最外层电子数确定最高化合价,书写氧化物化学式;
(4)单质与氢气反应越剧烈,化学性质越活泼;氧化剂氧化性强于氧化产物氧化性.
解答 解:(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中金属性最强的为K,非金属性最强的元素为F;稀有气体Ne原子最外层为稳定结构,化学性质最不活泼,故答案为:K;F;Ne;
(2)金属性K>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性KOH大于Mg(OH)2,故答案为:大于;
(3)Si元素原子核外电子数为14,有3个电子层,最外层电子数为4,处于第三周期ⅣA族,最外层电子数最高化合价为+4,最高价氧化物化学式为SiO2,其最高价氧化物对应水化物的化学式为H2SiO3,
故答案为:三;ⅣA;SiO2;H2SiO3;
(4)氢气与氧气点燃燃烧,而氢气与氯气在光照下发生爆炸,说明氯气与氢气反应更剧烈,化学性质活泼性:O2小于Cl2;Cl2+2NaBr=Br2+2NaCl中氯气为氧化剂,溴为氧化产物,故氧化性Cl2大于Br2,故答案为:小于;大于.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析和应用能力的考查,注意元素化合物知识、元素周期律的应用,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:推断题
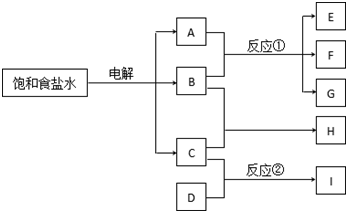 下列每一方框中的字母代表一种反应物或生成物:
下列每一方框中的字母代表一种反应物或生成物:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×(10-14+10-10)mol•L-1 | B. | $\frac{1×{(10}^{-14}{+10}^{-10})}{2}$mol•L-1 | ||
| C. | 2×10-10mol•L-1 | D. | 2×10-14mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40℃时同浓度的H2O2的分解速率一定比10℃时分解速率快 | |
| B. | 实验室用氯酸钾制氧气,增大压强可使反应速率加快 | |
| C. | 改变固体表面积对化学反应速率没有影响 | |
| D. | 在可逆反应中,因受反应限度的影响,研究改变外界条件来提高产率是没有意义的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 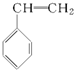 | B. | 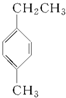 | C. | 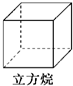 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双键、三键中一定含有π键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 因每个原子未成对电子数是一定的,故配对原子个数也一定 | |
| D. | 每一个原子轨道在空间都具有方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com