
【题目】25℃下部分弱酸的电离常数如表。下列有关说法不正确的是

A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c( HCOOH)/c(HCOO-)=10
B. 相同pH的 HCOONa和NaClO溶液中离子总浓度前者大
C. 等浓度等体积的Na2S和 HCOOH混合后:c(Na+)=2c(HCOO-)+2c( HCOOH)
D. 向NaClO溶液中通入H2S发生的反应为ClO-+H2S![]() HS-+HClO
HS-+HClO
【答案】D
【解析】
A. Ka=1.0×10-4=![]() =
=![]() ,可得c( HCOOH)/c(HCOO-)=10,故不选A;
,可得c( HCOOH)/c(HCOO-)=10,故不选A;
B.由两溶液中的电荷守恒式:c(Na+)+c(H+)=c(HCOO-)+c(OH-)和c(Na+)+c(H+)=c(ClO-)+c(OH-),由于次氯酸的酸性弱于甲酸,因此次氯酸根的水解能力大于甲酸根离子,次氯酸钠溶液的pH值大于甲酸钠,所以次氯酸钠溶液中的H+浓度小于甲酸钠溶液,由电荷守恒式可知,由于两溶液中的离子均只带一个单位的电荷,则阴离子浓度之和等于阳离子浓度之和,而两溶液中的钠离子浓度相等,H+浓度大的,则离子总浓度就大,所以离子总浓度是前者大于后者,故不选B;
C.等浓度等体积的Na2S和 HCOOH混合后,根据物料守恒:c(Na+)=2c(HCOO-)+2c( HCOOH),故不选C;
D.因为NaClO具有强氧化性,硫化氢具有还原性,两者混合会发生氧化还原反应,ClO-+H2S=S↓+Cl-+H2O,故选D;
答案:D


科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______mol2L-2;该温度下,pH=2的H2SO4溶液中由水电离出的[H+]为_________ molL-1。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为__________________(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=______ molL-1,a____ b(填“﹥”、“﹤”或“=”)。
(4)常温下,稀释0.5 mol·L1的醋酸溶液,下图中的纵坐标不能表示_________

A.CH3COOH的电离程度 B.溶液中H+的数目
C.溶液中![]() 的值 D.溶液中CH3COOH的浓度
的值 D.溶液中CH3COOH的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
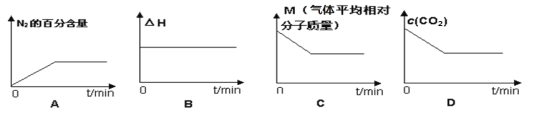
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是

A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加
B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动
D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。

②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
回答如下问题:

(1)0→t2时间段内反应速率增大的原因是: _________________________________ ,
(2)t2→t时间段内反应速率减小的原因是: _______________ ,
(3)图中阴影部分“面积”表示t1→t3时间里________ 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各物质间有着一定的转化关系,下列各组物质间可以按下图所示直接转化的是

A.Na→Na2O→Na2CO3→Na2O2B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOHD.HCl→CuCl2→BaCl2→HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com