
分析 (1)n(CuO)=$\frac{8g}{{\begin{array}{l}{80g/mol}\end{array}}}$=0.1mol,根据Cu、O原子守恒得n(O)=n(CuO)═n(Cu)=0.1mol;固体由CuO生成Cu和Cu2O,减少的质量为氧元素的质量,即8g-6.8g=1.2g,减少的n(O)=$\frac{1.2g}{{\begin{array}{l}{16g/mol}\end{array}}}$=0.075mol,所以Cu2O中n(O)=0.1mol-0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol-2×0.025mol=0.05mol,据此计算两种物质物质的量之比;
(2)n(Cu)=0.1mol-2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,
m(Cu2O)=6.8g-3.2g=3.6g.
Cu2O和稀硫酸反应,铜和稀硫酸不反应,根据氧化亚铜和Cu之间的关系式计算;
(3)①通过②分析知,6.8克的铜和氧化亚铜的混合物与硝酸反应相当于4.8克的铜与硝酸反应.
设铜与硝酸反应全部生成二氧化氮,二氧化氮的体积为:
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
64g 44.8L
4.8g 3.36L
设铜与硝酸反应全部生成一氧化氮,一氧化氮的体积为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 44.8L
4.8g 1.12L.
1.12L<1.568L<3.36L,所以该气体是二氧化氮和一氧化氮的混合物;
再结合方程式计算.
解答 解:(1)n(CuO)=$\frac{8g}{{\begin{array}{l}{80g/mol}\end{array}}}$=0.1mol,根据Cu、O原子守恒得n(O)=n(CuO)═n(Cu)=0.1mol;固体由CuO生成Cu和Cu2O,减少的质量为氧元素的质量,即8g-6.8g=1.2g,减少的n(O)=$\frac{1.2g}{{\begin{array}{l}{16g/mol}\end{array}}}$=0.075mol,所以Cu2O中n(O)=0.1mol-0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol-2×0.025mol=0.05mol,所以n(Cu)与n(Cu2O)之比是2:1,
故答案为:2:1;
(2)n(Cu)=0.1mol-2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,
m(Cu2O)=6.8g-3.2g=3.6g.
Cu2O和稀硫酸反应,铜和稀硫酸不反应,设Cu2O和稀硫酸反应生成铜的质量为x.
氧化亚铜和稀硫酸反应的方程式为:
Cu2O+H2SO4=CuSO4+Cu+H2O
144g 64g
3.6g x
144g:64g=3.6g:x
x=1.6g
所以可得到固体的质量=3.2g+1.6g=4.8g,故答案为:4.8;
(3)①通过②分析知,6.8克的铜和氧化亚铜的混合物与硝酸反应相当于4.8克的铜与硝酸反应.
设铜与硝酸反应全部生成二氧化氮,二氧化氮的体积为:
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
64g 44.8L
4.8g 3.36L
设铜与硝酸反应全部生成一氧化氮,一氧化氮的体积为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 44.8L
4.8g 1.12L
1.12L<1.568L<3.36L,所以该气体是二氧化氮和一氧化氮的混合物;
设生成一氧化氮的物质的量为ymol,生成二氧化氮的物质的量为zmol,
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 2mol
96yg ymol
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
64g 2mol
32zg zmol
$\left\{\begin{array}{l}{y+z=\frac{1.568}{22.4}}\\{96y+32z=4.8}\end{array}\right.$
解得$\left\{\begin{array}{l}{y=0.04}\\{z=0.03}\end{array}\right.$,
所以一氧化氮和二氧化氮的物质的量之比为4:3,故答案为:NO、NO2;4:3.
点评 本题考查化学方程式计算,为高频考点,侧重考查学生分析计算能力,明确物质性质及物质之间关系式是解本题关键,注意(3)题要确定气体成分,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下2.2gCO2中含有共用电子对的数目为2NA | |
| B. | 标准状况下,11.2L苯中含的碳原子数为3NA | |
| C. | 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A、B均能发生消去反应,则C一定能发生消去反应 | |
| B. | 若 A、B分子中分别含有1个、2个碳原子,则C的摩尔质量不小于60g.mol-1 | |
| C. | 若A是乙醇,则B可能是丙三醇 | |
| D. | 若A、B均存在醇类同分异构体,则 C一定存在醇类同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
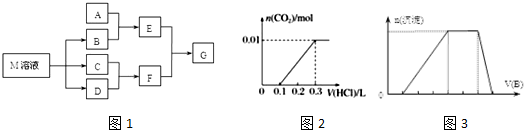
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
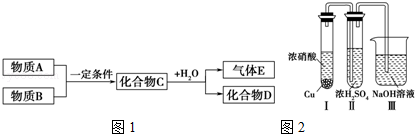
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液跟铜反应 Cu+Ag+=Cu2++Ag | |
| B. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 钠跟水反应 2 Na+2H2O=2 Na++2OH-+H2↑ | |
| D. | 碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
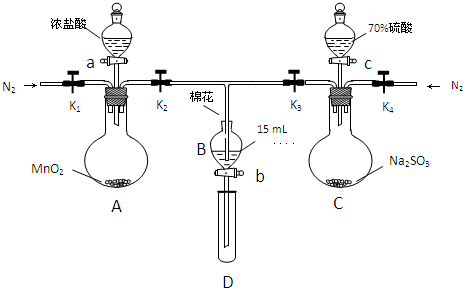
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
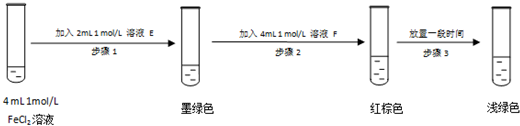
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com