
700℃时,在容积为2 L的密闭容器中发生反应CO(g)
+ H2O(g) CO2(g)
+ H2(g),部分数据见下表(表中t2>t1):
CO2(g)
+ H2(g),部分数据见下表(表中t2>t1):
|
反应时间/min |
n(CO)/mol |
n(H2O)/mol |
n(CO2)/mol |
n(H2)/mol |
|
0 |
1.20 |
0.60 |
0 |
0 |
|
t1 |
0.80 |
|
|
|
|
t2 |
|
0.20 |
|
|
下列说法正确的是
A.反应在t1 min内的反应速率为v(H2)=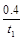 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
B
【解析】
试题分析:A、反应在t1
min内的反应速率为: ,错误;B、只要温度不变,平衡常数就不变,依平衡常数可知,保持其他条件不变,起始时向容器中充入0.60 mol
CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol,正确;C、
,错误;B、只要温度不变,平衡常数就不变,依平衡常数可知,保持其他条件不变,起始时向容器中充入0.60 mol
CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol,正确;C、
CO(g)
+ H2O(g) CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
起始1: 1.2mol 0.6mol 0mol 0mol
转化: 0.4mol 0.4mol 0.4mol 0.4mol
平衡: 0.8mol 0.2mol 0.4mol 0.4mol
此时水的体积分数为:0.2/1.8=0.11
CO(g) + H2O(g) CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
起始2: 1.2mol 0.8mol 0mol 0mol
转化: xmol xmol xmol xmol
平衡2:(1.2-x)mol (0.8-x)mol xmol xmol
依题意有:
 解之得:x=0.48
解之得:x=0.48
因此第二次达平衡后,水的体积分数为:0.32/2=0.16>0.11,所以保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数也增大。错误;D、温度升高至800℃,上述反应的平衡常数为0.64<1,表明反应逆向移动,则正反应为放热反应,错误。
考点:化学平衡的有关知识。


科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.20 |
| t1 |
| 0.20 |
| t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
A、反应在t1 min内的反应速率为v(H2)=
| ||
| B、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | ||
| D、温度升高至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com