
【题目】现有1950g发烟硫酸(用a SO3H2O 表示),SO3和H2SO4的质量分数分别为0.2和0.8,加b g水稀释成某浓度的硫酸(用H2SO4![]() H2O 表示),则以下正确的是(允许最后一位数字不同)( )
H2O 表示),则以下正确的是(允许最后一位数字不同)( )
A.a=1.38B.a=1.31C.b=174D.b=129
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,其分子中各原子的原子半径大小关系为______,碳原子核外有___种运动状态不同的电子。
(2)氰化钠(NaCN)中,N元素显-3价,则非金属性N___________C(填“<”、“=”或“>”),写出氰化钠的电子式_______________。
(3)氰化钠属于剧毒物质,可用双氧水或硫代硫酸钠处理。
(a)用双氧水处理,发生的反应为:NaCN+H2O2+H2O→A+NH3↑,则A的化学式为___。
(b)NaCN与Na2S2O3二者等物质的量反应可得到两种含硫元素的离子,其中一种遇到Fe3+显血红色。写出该反应的离子方程式____________。
(4)NO2会污染环境,可用Na2CO3溶液吸收NO2并放出CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是______;恰好反应后,所得溶液呈弱碱性,则溶液中各离子浓度大小关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中氮元素是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180 mg/L。
(1)写出NH4Cl的电子式_________。
(2)写出与氯同周期,有2个未成对电子的原子的电子排布式:_______、________
(3)为除去废水中的NH4+,向103 L该污水中加入0.1 mol/L NaOH溶液,理论上需要NaOH 溶液的体积为_________L(计算结果保留两位小数)。
(4)若某污水中同时存在NH4+和NO3-时。可用下列方法除去:可先在酸性污水中加入铁屑将NO3-转化为NH4+后再除去,请配平下列离子方程式并标出电子转移的方向和数目:___Fe +___NO3- +___H+=___Fe2+ +___NH4+ +___H2O,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100 mL容量瓶中定容配成100 mL稀硫酸。
B.用某仪器量取20.00 mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用待测溶液润洗。
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1 mL。
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2 mL。
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
(1)正确操作步骤的顺序(用编号字母填写)___→A→___→___→___→F→___。
(2)用来量取10.00 mL浓硫酸的仪器是___。用NaOH溶液润洗碱式滴定管的目的是___。
(3)滴定中可选用的指示剂是___。滴定中,目光应___;判断滴定终点的现象是___;读数时,目光与凹液面的最低处保持水平。
(4)某学生实验时用稀硫酸润洗了锥形瓶,测定的浓度会偏___。(“偏高”、“偏低”、“无影响”)。
(5)该浓硫酸样品的浓度计算式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量。表示辛烷燃烧热的热化学方程式正确的是( )
A.2C8H18(l) +25O2(g)===16CO2(g)+18H2O(g) ΔH=-11035.2 kJ·mol-1
B.C8H18(l) +![]() O2(g) ===8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
O2(g) ===8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l) +![]() O2(g) ===8CO2(g)+9H2O(l) ΔH=—11035.2kJ·mol-1
O2(g) ===8CO2(g)+9H2O(l) ΔH=—11035.2kJ·mol-1
D.2C8H18(l) +25O2(g) ===16CO2(g)+18H2O(l) ΔH=-5517.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量小于150,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是______。
(2)若A能与NaHCO3溶液反应放出CO2气体,其结构可能有______种。
(3)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,则A的结构简式是______。
(4)若A与NaOH溶液在加热时才能较快反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有______种,其中不能发生银镜反应的物质的结构简式是______。写出该物质与氢氧化钠反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯临床主要用于治疗类风湿性关节炎、感冒发烧等。合成路线如下:

(1)贝诺酯的分子式______。
(2)A→B的反应类型是______;G+H→I的反应类型是______。
(3)写出化合物C、G的结构简式:C______,G______。
(4)写出满足下列条件的F同分异构体的结构简式(任写3种)______。
a.不能与FeCl3溶液发生显色反应;
b.能发生银镜反应和水解反应;
c.能与金属钠反应放出H2;
d.苯环上的一氯取代产物只有两种结构
(5)根据题给信息,设计从A和乙酸出发合成![]() 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
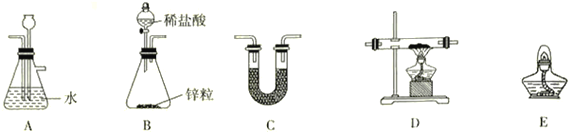
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
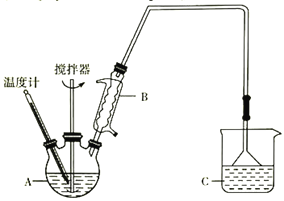
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
A. 3/2B. 2/3C. 6/5D. 5/6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com