
| A. | SO2在大气中能最终生成H2SO4:2SO2+O2+2H2O═4H++2SO42- | |
| B. | 少量SO2与NaOH溶液反应的离子方程式是:SO2+OH-═HSO3- | |
| C. | NaOH溶液缓慢吸收过量SO2的过程中有:SO2+SO32-+H2O═2HSO3- | |
| D. | n(SO2):n(NaOH)=1:2时,溶液pH>7:SO32-+H2O?HSO3-+OH- |
分析 A.二氧化硫具有还原性,能够被氧气氧化生成三氧化硫,三氧化硫与水反应生成硫酸;
B.二氧化硫少量,反应生成亚硫酸钠和水;
C.二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与二氧化硫、水反应生成亚硫酸氢钠;
D.n(SO2):n(NaOH)=1:2反应生成亚硫钠,亚硫酸钠为强碱弱酸盐,水解生成氢氧化钠、亚硫酸氢钠,所以溶液显碱性.
解答 解:A.SO2在大气中能与氧气、水反应氧化还原反应,最终生成H2SO4,离子方程式:2SO2+O2+2H2O═4H++2SO42-,故A正确;
B.少量SO2与NaOH溶液反应生成亚硫酸钠和水,离子方程式:SO2+2OH-═H2O+SO32-,故B错误;
C.二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与二氧化硫、水反应生成亚硫酸氢钠,离子方程式:SO2+SO32-+H2O═2HSO3-,故C正确;
D.n(SO2):n(NaOH)=1:2时,溶液pH>7,是因为反应生成的亚硫酸根离子水生成亚硫酸氢根离子和氢氧根离子,离子方程式:SO32-+H2O?HSO3-+OH-,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,注意盐类水解的规律,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 保持压强充入N2 | ||
| C. | 保持体积不变,增加O2 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在①中是氧化剂,在②中是还原剂 | |
| B. | Mn2+在①中是还原产物,在②中是氧化产物 | |
| C. | 在①中每生成1 mol O2,转移的电子数为2.408×1024 | |
| D. | 在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
. 为原料,制备化合物
为原料,制备化合物 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.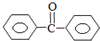 $→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$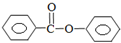
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
| A. | 硫酸钙悬浊液中存在CaSO4(s)?Ca2+(aq)+SO42-(aq) | |
| B. | 用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3 | |
| C. | 向Mg(OH)2悬浊液中滴加FeCl3,沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2 | |
| D. | 向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol/L的氯化钠溶液中取出10ml后,其浓度仍是1mol/L | |
| B. | NaHSO4溶液与NaOH溶液反应的离子方程式:H++OH-=H2O | |
| C. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| D. | 氧化剂具有氧化性,是得到电子(或电子对偏向)的物质,反应时本身被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CHO与新制氢氧化铜悬浊液加热反应,最后酸化 | |
| B. |  与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| C. |  与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| D. |  与氧气在催化剂、加热条件下反应 与氧气在催化剂、加热条件下反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com