Ⅰ:由于温室效应和资源短缺等问题,如何降低大气中的CO
2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO
2生产燃料甲醇.一定条件下发生反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),△H<0
(1)该反应平衡常数K的表达式为
.温度降低,平衡常数K
(填“增大”、“不变”或“减小”).
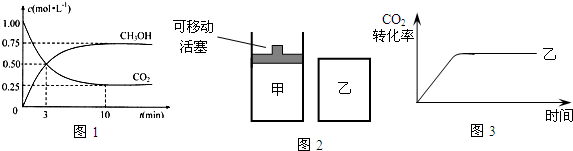
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,测得CO
2和CH
3OH(g)的浓度随时间变化如图1所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H
2)为
.
(3)下列措施中能使n(CH
3OH)/n(CO
2)增大的有
.
A.升高温度; B.加入催化剂;C.将H
2O(g)从体系中分离;D.再充入1mol CO
2和3mol H
2;
E.充入He(g),使体系总压强增大.
(4)如图2所示,在甲、乙两容器中分别充入物质的量之比为1:3 的CO
2和H
2,使甲、乙两容器初始容积相等.在相同温度下发生反应,并维持反应过程中温度不变.甲和乙相比,转化程度更大的是
,且知乙容器中CO
2的转化率随时间变化的图象如图3所示,请在图3中画出甲容器中CO
2的转化率随时间变化的图象.并请说明以CO
2为原料生产燃料甲醇的优点是
(写出一条即可).
Ⅱ:一定常温下,FeS的K
SP=2.5×10
-18,H
2S饱和溶液在该温度下,[H
+]与[S
2-]存在着以下关系:[H
+]
2?[S
2-]=1.0×10
-21.在该温度下,将适量FeS投入H
2S饱和溶液中,欲使溶液中[Fe
2+]达到1mol/L,应调节溶液的pH为
(用对数形式表示).(写出计算过程)



 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案