
A、F-的结构示意图: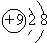 |
B、CO2的分子模型示意图: |
C、NaCl的电子式: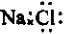 |
| D、Cr的外围电子排布式3d44s2 |
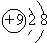 ,故A正确;
,故A正确; ,故B错误;
,故B错误;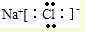 ,故C错误;
,故C错误;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3- |
| B、含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- |
| C、常温下由水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、含有溶质为NaHSO4的溶液:K+、SiO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
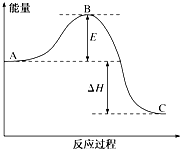 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.
现有8种元素,其中A、B、C、D、E为短周期主族元素,F、G、H为第4周期元素,其原子序数依次增大.请根据下列相关信息,回答问题.| A是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离分别是:I1=738kJ?mol-1 I2=1451kJ?mol-1 I3=7733kJ?mol-1 I4=10540kJ?mol-1 |
| D原子核外所有p轨道全充满或半充满 |
| E元素基态原子的核外电子排布为1s22s22p63s23p5 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第8列 |
| H元素原子价电子排布式为3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素随核电荷数的增加,第一电离能依次增大 |
| B、元素原子的最外层电子数等于元素的最高化合价 |
| C、同主族元素从上到下,单质的熔点逐渐降低 |
| D、第ⅦA元素从上到下,其氢化物的还原性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
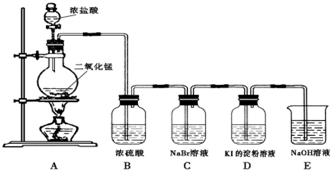
查看答案和解析>>
科目:高中化学 来源: 题型:
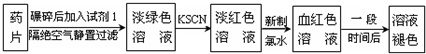
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol O2 的质量为 32 g/mol |
| B、SO42-的摩尔质量是 96 g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量是44 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com