
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把一段打磨过的镁带放入少量冷水中 | |
| C. | 把绿豆大的钾投入少量水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
分析 A.Cl2与FeCl2溶液发生氧化还原反应;
B.镁和冷水反应缓慢,基本无现象;
C.钾的密度比水小,可与水剧烈反应;
D.溴具有强氧化性,可氧化KI.
解答 解:A.Cl2与FeCl2溶液反应:Cl2+2FeCl2=2FeCl3,溶液由浅绿色变为棕黄色,现象明显,故A不选;
B.镁与冷水反应比较缓慢,现象不明显,可与沸水反应,故B选;
C.钾与水剧烈反应:2K+2H2O=2KOH+H2↑,钾迅速熔化成一小球,四处游动,发出嘶嘶的响声,有火焰产生,现象明显,故C不选;
D.单质溴与KI溶液反应:Br2+2KI=I2+2KBr,I2遇淀粉变蓝,现象明显,故D不选.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,难度不大.


科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (杂质) | 乙醇 (水) | 乙炔(H2S) | 溴苯 (溴) |
| 选用试剂 | |||
| 分离方法 | 1 |
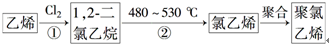
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A=HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
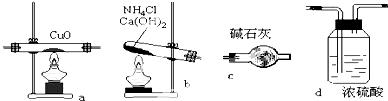 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com