
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
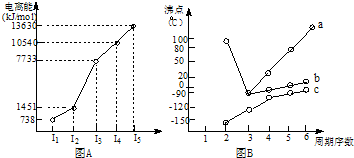
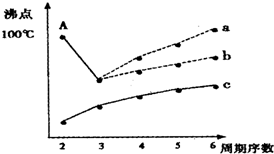
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
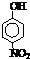 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

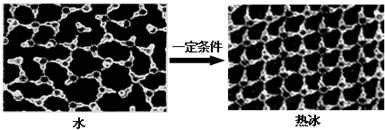
查看答案和解析>>
科目:高中化学 来源:潮阳一中2007届高三化学第一次月考新课标(人教) 人教版 新课标 题型:021
|
下列选项中正确的是 | |
A. |
微粒半径:F->Na+>Mg2+ |
B. |
键长越长、键能越大,表示该物质越稳定 |
C. |
基态原子的最外层电子排布为nsl的元素一定是金属元素 |
D. |
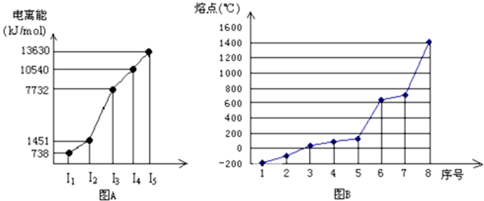
某主族元素的四个电离能数据分别是:I1=496kJ/mol、I2=4562kJ/mol、I3=6912kJ/mol、I4=9540kJ/mol,据此可以判断该元素的稳定价态是+1价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com