
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积
(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
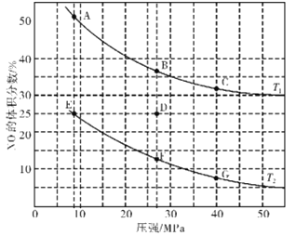
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
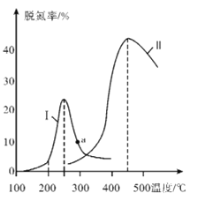
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
【答案】4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-2070kJmol-1 ac > A 温度较低时,催化剂的活性偏低 不是 因为该反应为放热反应,根据线Ⅱ可知,a点对应温度的平衡脱氮率应该更高 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】
(1) NH3还原NO反应的方程式为4NH3+6NO=5N2+6H2O,①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-1530kJmol-1,②N2(g)+O2(g)═2NO(g)△H2=+180kJmol-1,根据盖斯定律①-②×3得到NH3还原NO反应的热化学方程式;
(2) 如图所示NO的转化率a(NO)随X的增量而逐渐减小,说明平衡逆向移动;
(3)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)判断,升高温度,平衡向吸热方向移动;
②对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加;
③催化剂在低温下活性不大,反应随温度变化速率变化不大,图象分析可知a点不是对应温度下的平衡脱氮率;
(4) 由图可知,阴极上亚硫酸根离子得到电子生成S2O42-,NO吸收转化后的主要产物为NH4+,N元素的化合价由+2价降低为-3价,以此计算。
(1) NH3还原NO反应的方程式为4NH3+6NO=5N2+6H2O,①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-1530kJmol-1,②N2(g)+O2(g)═2NO(g)△H2=+180kJmol-1,由盖斯定律①-②×3有4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1530kJmol-1-(+180kJmol-1)×3=-2070kJmol-1,则NH3还原NO的热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-2070kJmol-1;
(2) 如图所示NO的转化率a(NO)随X的增量而逐渐减小,说明平衡逆向移动;
a.反应2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,则升高温度,平衡逆向移动,NO的转化率减小,与图象吻合,故a正确;
2ClNO(g) △H<0,则升高温度,平衡逆向移动,NO的转化率减小,与图象吻合,故a正确;
b.反应2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,则增大压强,平衡正向移动,NO的转化率增大,与图象不吻合,故b错误;
2ClNO(g) △H<0,则增大压强,平衡正向移动,NO的转化率增大,与图象不吻合,故b错误;
c.![]() 增大,说明是增减小Cl2的量或增大NO的量,NO的转化率均减小,与图象吻合,故c正确;
增大,说明是增减小Cl2的量或增大NO的量,NO的转化率均减小,与图象吻合,故c正确;
d.改变催化剂的接触面积,不影响平衡的移动,NO的转化率不变,与图象不吻合,故d错误;
故答案为ac;
(3)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)△H=-746kJmol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点;
(3)图象分析可知a点不是对应温度下的平衡脱氮率:温度较低时,催化剂的活性偏低;不是平衡脱氮率,因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高;
(4)①由图可知,阴极上亚硫酸根离子得到电子生成S2O42-,阴极区的电极反应式为2SO32-+4H++2e-=S2O42-+2H2O;
②NO吸收转化后的主要产物为NH4+,N元素的化合价由+2价降低为-3价,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为![]() ×22.4L/mol=1.344L=1344mL。
×22.4L/mol=1.344L=1344mL。


科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图.则下列叙述正确的是( )
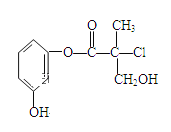
A.有机物A属于芳香烃
B.1molA和足量的NaOH溶液反应,最多可以消耗4mol NaOH
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A可以和Br2的CCl4溶液发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
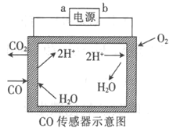
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将 a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为ω ,其中含NH4+的物质的量为 b moL。下列叙述中正确的是
A.溶质的质量分数为ω=![]() 100%
100%
B.溶质的物质的量浓度 c ![]() mol L1
mol L1
C.溶质一水合氨是强电解质
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是( )
]与混合液pH的关系如图所示。下列说法正确的是( )

A.f=0时,溶液中:c(Na+)=2c(![]() )
)
B.f=0.5时,溶液中:c(![]() )>c(
)>c(![]() )
)
C.f=1时,溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.f=2时,溶液中:![]() c(Na+)=c(
c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.1mol/L的 NaHSO4溶液中所含的氧原子数目为0.4NA
B. 1mol-OH(羟基)与1 mol H3O+中所含的电子数均为10NA
C. 7.1gCl2与足量Fe充分反应,转移的电子数为0.2NA
D. 80gCuO和Cu2S的混合物中,所含铜原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究学习小组要制备一种在水中溶解度很小的黄色化合物[Fex(C2O4)y·zH2O],并用滴定法测定其组成。已知H2C2O4在温度高于90℃时易发生分解。实验操作如下:
步骤一:将图甲分液漏斗中的草酸溶液滴入锥形瓶内,可生成黄色沉淀;
步嶸二:称取黄色产物0.841g于锥形瓶中,加入足量的硫酸并水浴加热至70~85℃。待固体全部溶解后,用胶头滴管吸岀一滴溶液点在点滴板上,用铁氰化钾溶液检验,无蓝色沉淀产生;
步骤三:用0.080mol/ LKMnO4标准液滴定步骤二所得的溶液;
步骤四:向步骤三滴定后的溶液中加足量的Zn粉和硫酸溶液,几分钟后用胶头滴管吸岀一滴点在点滴板上,用KSCN溶浟检验,若不显红色,过滤除去Zn粉,并用稀硫酸洗涤Zn粉,将洗涤液与滤液合并,用0.0800mol/ L KMnO4标准液滴定,用去髙锰酸钾标准液10.00mL。
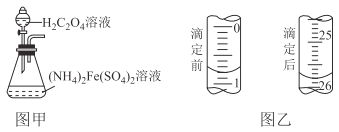
(1)步骤一中将沉淀从反应混合物中分离出来的操作名称是__________________。
(2)步骤二中水浴加热并控制温度70~85℃的理由是__________________,加铁氰化钾溶液无蓝色沉淀产生,此操作的目的是__________________。
(3)步骤三盛装KMnO4标准液的滴定管在滴定前后的液如图乙所示,则消耗KMnO4标准液的体积为__________________,该滴定管为_________滴定管(填“酸式”或“碱式”)
(4)步骤四中滴定时发生反应的离子方程式为___________________________。若不合并洗涤液,则消耗KMnO4标准液的体积将_________(填“增大”“减小”或“不变”)。由以上数据计算黄色化合物的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.聚四氟乙烯的单体属于不饱和烃
B.异丁烯及甲苯均能使溴水褪色,且褪色原理相同
C.苯乙烯(![]() )分子的所有原子不可能在同一平面上
)分子的所有原子不可能在同一平面上
D.分子式为C4H10O且属于醇类的同分异构体有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com