
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水,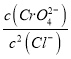 增大
增大
【答案】D
【解析】
A.依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)
2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)![]() Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
B.在难溶化合物的溶解平衡曲线下方的点,溶液中离子浓度幂之积大于其Ksp,可以形成该物质的沉淀,在溶解平衡曲线上方的点溶液中离子浓度幂之积小于其Ksp,不可以形成该物质的沉淀,M区域在AgCl溶解曲线上方而处于Ag2CrO4沉淀下方,所以M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀,B正确;
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,形成AgCl沉淀需要Ag+的浓度c(Ag+)=![]() =10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=
=10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=![]() =3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
=3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水,其中仍然存在Ag2CrO4、AgCl的沉淀溶解平衡,温度不变,所以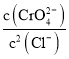 不变,D错误;
不变,D错误;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
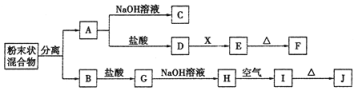
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。

(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A~H的相互转化关系如图所示(图中副产物均未写出):
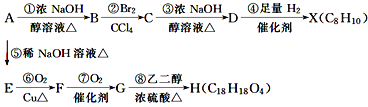
其中A的相对分子质量比X大34.5,请回答:
(1)写出有机物的结构简式:A__;H__。
(2)写出下列反应的化学方程式:
反应③__。
(3)B分子内处于同一平面上的原子最多有__个,B在一定条件下可以发生反应生成高分子化合物N,则N的结构简式为__。
(4)化合物M是G的一种同分异构体,M具有如下性质:
①不与NaHCO3反应,②遇FeCl3溶液显紫色,③1molM恰好与2molNaOH反应,
则M的结构简式为__(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅黄绿色,说明氯水中含有![]()
B. 干燥氯气与湿润氯气漂白性的对比实验证明,氯水中具有漂白性的微粒是![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向![]() 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有
溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
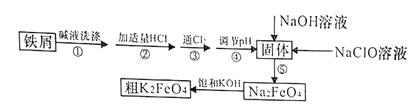
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com