
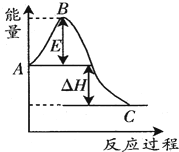
 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).分析 (1)从能量变化图可知A、C点的含义,A为反应物能量,C为生成物能量;
(2)从催化剂对活化能的影响分析,降低反应的活化能加快反应速率;
(3)达到平衡时,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,由求得放出18.4KJ能量物质的量的变化,进而求得按化学计量数反应的热效应,从而写出热化学方程式.
解答 解:(1)从能量变化图可知,A点代表反应物具有的总能量,C点代表生成物具有的总能量,
故答案为:反应物具有的总能量,生成物具有的总能量;
(2)使用催化剂,降低了反应所需活化能,活化分子百分数增加,反应速率加快,
故答案为:降低;
(3)根据方程式计算△H
物质的量变化为:1+3-3.6=0.4,放出18.4KJ能量,物质的量变化为:1+3-2=2时,对应的能量变化为X
N2(g)+3H2(g)?2NH3(g)△n∽Q
1 3 2 2 X
0.4 0.4 18.4
X=$\frac{2×18.4}{0.4}$=92,即△H=-92kJ/moL.
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/moL.
点评 本题综合考察了反应热与化学平衡的计算题.巧妙运用差量法可快速求解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
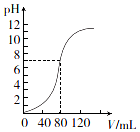 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
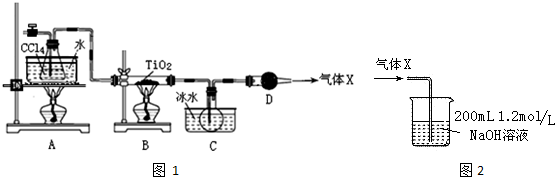
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
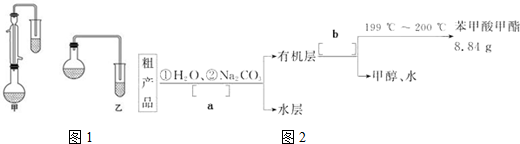
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com