
分析 (1)氢气燃烧的产物只有水;
(2)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,结合转移电子守恒配平方程式,判断电子转移数目;
(3)镍氢电池根据总反应:MH+NiOOH=M+Ni(OH)2 ,放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,以上式中M为储氢合金,MH为吸附了氢原子的储氢合金,据此分析解答.
解答 解:(1)依据元素守恒可知,氢气燃烧的产物只有水,故答案为:水;
(2)NaBH4与水发生氧化还原反应生成NaBO2和H2,H元素化合价由-1价、+1价变为0价,要使氧化还原反应得失电子守恒,则反应的化学方程式为:NaBH4+2H2O=NaBO2+4H2↑,依据方程式可知:反应消耗1mol NaBH4时转移的电子数目4mol;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;4mol;
(3)①M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高;
故答案为:越大;
②镍氢电池根据总反应:MH+NiOOH=M+Ni(OH)2 ,放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-;MH+OH--e-=M+H2O;
③依据总方程式MH+NiOOH=M+Ni(OH)2 可知:该电池的反应物为碱性物质,应使用碱性溶液做电解质;
故答案为:碱性溶液.
点评 本题考查了氧化还原反应方程式配平及书写,原电池和电解池原理,明确氧化还原反应规律,熟悉原电池、电解池工作原理是解题关键,难点在于电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将食物存放在温度低的地方 | |
| B. | 将块状固体药品研细后再反应 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用4 mol/LH2SO4溶液代替1 mol/LH2SO4溶液与锌粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 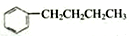 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可用于实验室制备少量Cl2或NH3 | |
| B. | 可用从a处加水的方法检验装置②的气密性 | |
| C. | 实验室也可以用装置③收集HCl气体 | |
| D. | 装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: | |
| C. | CaCl2的电子式: | |
| D. | 明矾的化学式:KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 红磷和白磷 | ||
| C. | 丁烷和异丁烷 | D. | ${\;}_{19}^{40}$K和${\;}_{20}^{40}$Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com