
| A.需要加热才能发生的反应一定是吸热反应 |
| B.伴有能量变化的物质变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| D.任何化学反应都伴随着能量变化 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.需要加热方能发生的反应一定是吸热反应 |
| B.放热的反应在常温下一定很容易发生 |
| C.放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 |
| D.吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
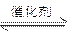 2NH3,有关说法正确的是( )
2NH3,有关说法正确的是( )| A.不同的催化剂对化学反应速率影响均相同 |
| B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景 |
| C.新法合成能在常温下进行是因为不需要断裂化学键 |
| D.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7/2<b<14/3 | B.7<b<28/3 | C.8<b<13 | D.9 <b<12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl和SiO2晶体熔化时,克服粒子间作用力的类型不相同 |
| B.将烧黑的铜丝伸入酒精灯火焰的焰心又变红色光亮 |
| C.氯化亚铁溶液长期敞放于空气中会因被氧化而呈黄色 |
D.室温下,某溶液中由水电离出的c(H+)=10 mol·L mol·L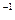 ,则此溶液可能是稀硫酸 ,则此溶液可能是稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com