
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
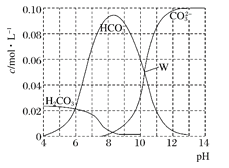
A. W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
【答案】B
【解析】试题分析:A、W点所示的溶液呈电中性,即c(正电荷) = c(负电荷),则c(Na+) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),不能漏了碳酸氢根离子所带负电荷浓度,A错误;B、由物料守恒原理可知,c(H2CO3) + c(HCO3-) + c(CO32-) + c(CO2) =" 0.1" mol·L-1,由于饱和碳酸的pH=5.6,则pH = 4的溶液中已经逸出部分CO2,则c(H2CO3) + c(HCO3-) + c(CO32-) < 0.1 mol·L-1,B正确;C、由电荷守恒原理可得:c(Na+) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),由物料守恒原理可得:c(Na+) =" 2" c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-),则2 c(H2CO3) + 2 c(HCO3-) + 2 c(CO32-) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH-) + c(Cl-),即2 c(H2CO3) + c(HCO3-) + c(H+) = c(OH-) + c(Cl-),不能漏了H2CO3浓度的2倍,C错误;D、根据图像可知pH=11时,Na2CO3的浓度远远大于NaHCO3,说明反应Na2CO3+HCl=NaCl+NaHCO3中参加反应的Na2CO3较少,过量的Na2CO3较多,由过量的Na2CO3及等量NaCl、NaHCO3的电离及NaHCO3的水解规律可知,c(Na+) > c(CO32-) > c(Cl-) > c(HCO3-) > c(H2CO3),D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图a所示(部分产物已略去)。

(1)若A为非金属单质,D是空气的主要成分之一,请写出B的电子式______________。
(2)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为_____________________。
(3)若A为强碱,D为气态氧化物。B的水溶液露置于空气中一段时间,其pH变化如图b所示,则其pH变化的原因是____________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=c(OH-)=10-6mol/L溶液
C. 使石蕊试液呈紫色的溶液 D. 酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是一种验证某气体化学性质的实验装置,图中 B 为开关。如先打开 B,在A处通入干燥氯气,C 处红色布条颜色无变化;当关闭B,继续通入Cl2 时,C处红色布条颜色褪去。则 D 瓶中盛有的溶液是( )

A. 饱和 NaCl 溶液
B. 浓 H2SO4
C. NaOH 溶液
D. Ca (OH) 2 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以化合物1为原料,按下列路线制备聚合物8。

已知:R—X![]() R—CN
R—CN![]() R—COOH
R—COOH
R—CH2COOH![]()
![]()
请回答:
(1)以下四个化合物中,含有羧基的是
A.化合物3 B.化合物4 C.化合物6 D.化合物7
(2)化合物4→8的合成路线中,未涉及的反应类型是
A.取代反应 B.消去反应 C.加聚反应 D.还原反应
(3)下列四个化合物中,与化合物4互为同系物的是
A.CH3COOC2H5B.C6H5COOH
C.CH3CH2CH2COOH D.CH3COOH
(4)化合物4的属于酯类的所有同分异构体的结构简式 。
(5)化合物7→8的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓盐酸、浓硫酸、浓硝酸均属于强电解质
B. SiO2、SO2、SO3均属于酸性氧化物
C. 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液
D. 纯碱的分子式是Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
A.c(NH4+):③ > ②
B.pH:① > ② > ③
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) ![]() Mg2+ (aq) + 2OH- (aq)向溶解方向移动
Mg2+ (aq) + 2OH- (aq)向溶解方向移动
D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将___________中(填“增大”、“减小”或“不变”),溶液中![]() 比值___________(填“增大”、“减小”或“不变”).
比值___________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com