
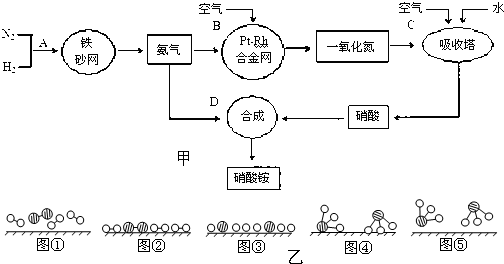
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
| ||
| △ |
| 1mol |
| 1mol+0.8832mol |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
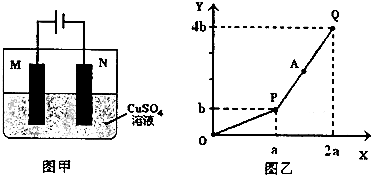
| A、电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B、A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C、Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D、若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
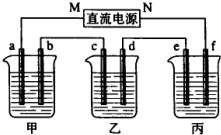 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量氯气和溴化亚铁溶液反应:C12+2Br-=2Cl-+Br2 |
| B、氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
| C、蛋壳溶于食醋中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、金属钠投入硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率 |
| D、铝在空气中不易腐蚀,不用特殊方法保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com