
【题目】工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝.
(1)有一种用CO2生产甲醇燃料的方法:CO2+3H2CH3OH+H2O 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
CH3OH(g)═CH3OH(l)△H=﹣c kJmol﹣1;
则表示CH3OH(l)燃烧热的热化学方程式为: .
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)制备.图1为此反应的反应速率随温度变化的曲线,图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.回答下列问题: 
①0~6min内,反应的平均速率v(Cl2)=;
②10min改变的条件是 , 该反应平衡常数变化的趋势是(填“增大”、“减小”或“不变”).
(3)利用氨水可以将SO2和NO2吸收,原理如图3所示:NO2被吸收的离子方程式是 . 
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如图4,判断B为电源的极,电解时阳极的电极反应式为 . 
【答案】
(1)CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJ?mol﹣1
b+2c﹣a﹣d)kJ?mol﹣1
(2)0.15mol?L﹣1?min﹣1;升高温度;减小
(3)2NO2+4HSO3﹣═N2+4SO42﹣+4H+
(4)正;Si+4H﹣﹣4e﹣═SiH4↑
【解析】解:(1)①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣a kJmol﹣1; ②2H2(g)+O2(g)═2H2O(g)△H=﹣b kJmol﹣1;
③H2O(g)═H2O(l)△H=﹣c kJmol﹣1;
④CH3OH(g)═CH3OH(l)△H=﹣d kJmol﹣1 ,
由盖斯定律可知,②× ![]() +③×2﹣①﹣④得到CH3OH(l)+
+③×2﹣①﹣④得到CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1 ,
b+2c﹣a﹣d)kJmol﹣1 ,
则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2(l)△H=﹣(
O2(g)=CO2(g)+2H2(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1 ,
b+2c﹣a﹣d)kJmol﹣1 ,
所以答案是:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣(
O2(g)=CO2(g)+2H2O(l)△H=﹣( ![]() b+2c﹣a﹣d)kJmol﹣1;(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L﹣0.3mol/L=0.9mol/L,则v(Cl2)=
b+2c﹣a﹣d)kJmol﹣1;(2)①由图可知,6min时Cl2的平衡浓度为0.3mol/L,浓度变化为1.2mol/L﹣0.3mol/L=0.9mol/L,则v(Cl2)= ![]() =0.15 molL﹣1min ﹣1 ,
=0.15 molL﹣1min ﹣1 ,
所以答案是:0.15 molL﹣1min﹣1 ;
②影响平衡移动的因素有温度、浓度和压强,该反应是放热反应,由图可知,第10 min时平衡逆向移动,只能是升温,由图1可知,升温平衡向逆反应方向移动,正反应为放热反应,所以温度高,平衡常数减小,
所以答案是:升高温度;减小;(3)二氧化氮具有强的氧化性,能够氧化亚硫酸氢根离子生成硫酸根离子,二氧化氮被还原为氮气,离子方程式:2NO2+4HSO3﹣=N2+4SO42﹣+4H+;
所以答案是:2NO2+4HSO3﹣═N2+4SO42﹣+4H+;(4)从图示知,粗硅变化为SiH4 , 失电子发生氧化反应,B为电源的正极,H﹣移向阳极生成SiH4 , 电极反应式为Si+4H﹣﹣4e﹣=SiH4↑,
所以答案是:正; Si+4H﹣﹣4e﹣═SiH4↑;
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】关于晶体的叙述中,正确的是( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学学习和研究的说法错误的是( )
A.化学模型有助于解释一些化学现象B.质量守恒定律是大量实验事实的总结
C.化学家提出的假设都能被实验证明D.化学基本原理的应用是有一定条件的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置.
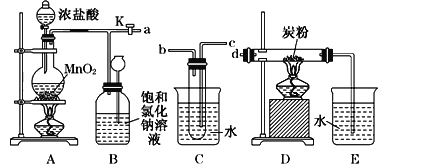
(1)写出实验室制取氯气的离子方程式________________________________________;
(2)要将C装置接入B和D之间,正确的接法是:a→____→____→d;
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为______.
(4)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______,B的作用是______.
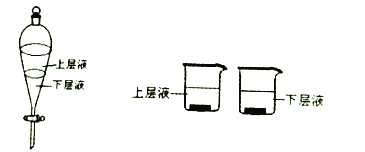
(5)用量筒量取20mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,能使有色布条褪色的是______(填“上层液”或“下层液”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,挪威和荷兰正在开发一种新能源﹣﹣盐能.当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%,海水和淡水混合时,温度升高最可能的原因是( )
A.由于浓度差产生放热
B.发生了水分解反应
C.发生了盐分解反应
D.盐的溶解程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,Ksp[Mg(OH)2]=1.1×10﹣11 , Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12Ksp(CH3COOAg)=2.3×10﹣3 , 下列叙述不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 molL﹣1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、磷等单质及其化合物的反应有重要意义.
(1)试判断用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下能否自发进行(填“能”或“否”).已知:在298K、100kPa下该反应的△H=﹣113.0kJmol﹣1 , △S=﹣145.3Jmol﹣1K﹣1 .
(2)25℃下,将a molL﹣1的氨水与0.005molL﹣1的硫酸等体积混合,反应平衡时溶液中c(NH4+)=2c(SO42﹣),用含a的代数式表示NH3H2O的电离常数Kb= .
(3)25℃时,Ksp(BaSO4)=1.1×10﹣10 , Ksp(BaCO3)=2.6×10﹣9 , 现将BaCl2溶液滴入浓度均为0.01molL﹣1的Na2SO4和Na2CO3的混合溶液中,当两种沉淀共存时,溶液中c (CO32﹣):c(SO42﹣)=(不考虑CO32﹣的水解)
(4)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式: .
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH﹣)﹣c(H3PO2)= . 该温度下将pH=a的盐酸Vaml与pH=b的氢氧化钠Vbml混合后溶液呈中性,且a+b=10,则Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3、NaHCO3说法正确的是
A. 受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2
B. 等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多
C. 向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀
D. 等物质的量的两种盐与足量盐酸完全反应,所消耗HCl的物质的量Na2CO3是NaHCO3的两倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com