
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
分析 A.金属晶体含有阳离子,但不含阴离子;
B.电子云表示电子出现的几率;
C.溶液的导电能力和离子浓度成正比;
D.质谱法可测定有机物的相对分子质量.
解答 解:A.金属晶体由金属离子和自由电子构成,含有阳离子,但不含阴离子,故A错误;
B.电子云表示电子出现的几率,即表示电子在核外单位体积的空间出现的机会多少,故B正确;
C.溶液的导电能力与离子浓度成正比,与电解质的强弱无关,故C错误;
D.质谱法可测定有机物的相对分子质量,为有机物实验式和分子式确定中常用的方法,故D错误;
故选B.
点评 本题考查金属晶体的组成、电子云以及导电能力的判断,为高频考点,侧重于基础知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na4S2O3 | B. | CaOCl2 | C. | KAl(SO4)2 | D. | Ca(NO3)Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中化合价升高的元素是NH3中的H | |
| B. | 该反应利用了Cl2的强还原性 | |
| C. | NH3在反应中得到电子 | |
| D. | 生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2C2H5OH
+2C2H5OH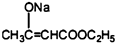 +CH3COOH→
+CH3COOH→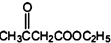 +CH3COONa
+CH3COONa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com