
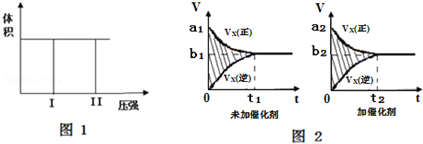
分析 (1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应;正反应后气体的物质的量减少,所以混乱度减小,△H-T△S<0反应自发进行;
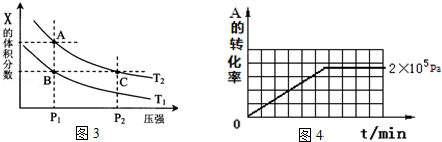
(2)加入催化剂,反应速率加快,到达平衡的时间缩短,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快;
B.A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变;
C.B、C两点X的体积分数相同,则相同组分的体积分数相同;
D.压强相同,升高温度,化学平衡向吸热反应移动;
(Ⅱ)(1)根据压强变化与浓度变化关系分析;
(2)反应前后气体的物质的量不变;
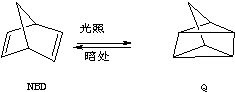
(3)2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,A的转化率减小,反应速率增大时间缩短.
解答 解:(1)正反应为气体物质的量减小的反应,容器的容积不变,由图可知,状态Ⅱ的压强大于状态Ⅰ压强的2倍,反应在绝热条件下进行,说明正反应为放热反应,则△H<0;正反应后气体的物质的量减少,所以混乱度减小,则△S<0,△H-T△S<0反应自发进行,该反应在低温条件下能自发进行,
故答案为:<;<;低温;
(2)加入催化剂,反应速率加快,所以b1<b2,到达平衡的时间缩短,所以t1>t2,平衡不移动,阴影部分为反应物浓度变化量,则两图中阴影部分面积相等,
故答案为:②③⑤;
(3)A. A、C两点都在等温线上,压强A点小于C点,压强越大速率越快,所以反应速率A<C,故A错误;
B. A、C两点都在等温线上,反应前后气体物质的量不变,压强越大,容器的容积越小,而混合气体总质量不变,所以气体密度:A<C,故B正确;
C. B、C两点X的体积分数相同,则相同组分的体积分数相同,所以气体的平均相对分子质量相同,故C错误;
D. 由状态B到状态A,压强相同,温度不同,正反应为放热反应,升高温度化学平衡向吸热反应移动,X的体积分数增大,所以可以通过升温使状态B到状态A,故D正确;
故答案为:BD;
(Ⅱ)(1)由表格数据可知当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为$\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动,
故答案为:不;
(2)由(1)可知,增大压强平衡不移动,所以反应前后气体的物质的量不变,所以当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+b,
故答案为:a+b;
(3)2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,平衡逆移,A的转化率减小,反应速率增大,时间缩短,依此作图为: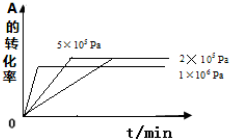 ,
,
故答案为: .
.
点评 本题考查了平衡常数、平衡移动、平衡图象等,综合性较强,难度中等,注意对图象和表格数据的分析是解题的关键,考查了学生分析图象提取图象信息的能力.


科目:高中化学 来源: 题型:选择题
| A. | 胶体一定是混合物 | |
| B. | 丁达尔效应可用于鉴别胶体和溶液 | |
| C. | 明矾溶于水可产生具有吸附性的胶体粒子,常用于净化自来水 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其与空气形成的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1| A. | △H1>△H2 | B. | 等质量NBD的能量比Q的能量高 | ||
| C. | NBD比Q稳定 | D. | NBD转化为Q是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
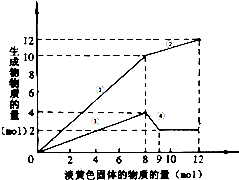 某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.
某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>甲烷 | |
| B. | 二氯甲烷有两种不同结构的同分异构体 | |
| C. | C2H4与C4H8一定是同系物 | |
| D. | 甲苯的一氯代物有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com