
| A. | B>D>C>A | B. | C>A>B>D | C. | A>C>D>B | D. | A>B>C>D |
分析 A、B、C、D四块金属,若A、B用导线相连成原电池时,A为负极,则金属性A>B;若C、D相连构成原电池时,电流由D流向C,则C为负极,金属性C>D;A、C相连浸入稀硫酸中时,C极上产生大量气泡,则C为正极、A为负极,则金属性A>C;把D投入到B的硫酸盐溶液中,D的表面有B析出,则金属性D>B,据此可判断金属性强弱.
解答 解:A、B用导线相连成原电池时,A为负极,则金属性A>B;若C、D相连构成原电池时,电流由D流向C,则C为负极,金属性C>D;A、C相连浸入稀硫酸中时,C极上产生大量气泡,则C为正极、A为负极,则金属性A>C;把D投入到B的硫酸盐溶液中,D的表面有B析出,则金属性D>B,
根据分析可知,四种金属的活动性顺序为:A>C>D>B,
故选C.
点评 本题考查了原电池工作原理的应用,题目难度不大,明确原电池两极与金属活泼性的关系为解答关键,注意掌握原电池工作原理,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:3:1 | B. | 1:3:2 | C. | 2:3:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
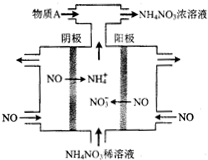
| A. | NO是常见的大气污染物之一,该装置可实现废气的治理与回收利用 | |
| B. | 阳极反应为:NO-3e-+2H2O═NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+═NH4++H2O | |
| D. | 为使电解产物全部转化为NH4NO3,需向该电解池中补充水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .其中心原子的杂化类型为sp3.
.其中心原子的杂化类型为sp3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 关闭活塞c,打开活塞a、b,挤压胶头滴管,Ⅱ中产生喷泉 | |
| B. | 关闭活塞a,打开活塞b、c,用热毛巾敷热烧瓶I,I中产生喷泉 | |
| C. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,I中会产生白雾 | |
| D. | 关闭活塞b,打开活塞a、c,用热毛巾敷热烧瓶II,一段时间后,打开活塞b,I、II中均产生喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于p% | B. | 大于p% | ||
| C. | 小于p% | D. | 达到平衡的时间乙更长 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com