
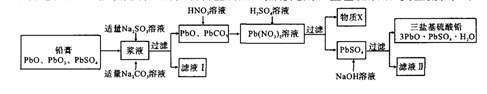
 。
。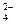 +2H2O(3分)
+2H2O(3分)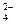 +2H2O。洗涤沉淀(或固体)沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次。根据Na2SO3~2
+2H2O。洗涤沉淀(或固体)沿玻璃棒向漏斗(过滤器)中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复操作数次。根据Na2SO3~2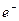 ~PbO2可以确定n(Na2SO3)=n( PbO2)=
~PbO2可以确定n(Na2SO3)=n( PbO2)=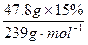 =0.03mol。
=0.03mol。

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题

| A.当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作 |
B.放电时,负极反应为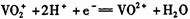 |
| C.充电时,阳极附近溶液由绿色逐渐变为紫色 |
| D.放电过程中,正极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放电时储氢合金作正极 |
| B.放电时负极反应为:LaNi5H6-6e-=LaNi5+6H+ |
| C.充电时阳极周围C(OH-)减小 |
| D.充电时储氢合金作负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
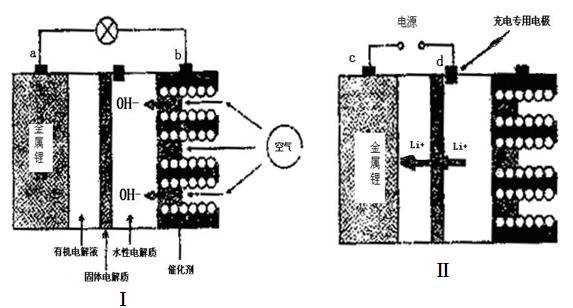
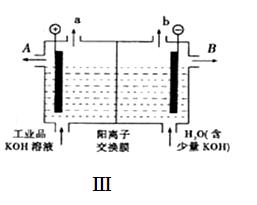
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2在负极发生氧化反应 |
| B.燃料电池的能量转化率可达100% |
| C.产物为无污染的水,属于环境友好电池 |
| D.供电时的总反应为:2H2 + O2 = 2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
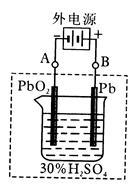
 Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同状况下两电极上产生的气体体积之比为2 :1 |
| B.两电极上产生的气体质量之比为8 :1 |
| C.相同状况下两电极上产生的气体体积之比为4 :1 |
| D.若两电极上产生的气体质量比为16 :3,则D2O与H2O的物质的量之比为1 :1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
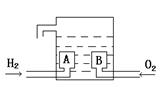
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极反应为2H2 + 4OH- — 4e- = 4H2O | D.正极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com