
| A. | $\frac{27m}{v}$mol/L | B. | $\frac{m}{9v}$mol/L | C. | $\frac{m}{27v}$mol/L | D. | $\frac{m}{18v}$mol/L |
分析 先根据n=$\frac{m}{M}$计算铝离子的物质的量,根据c=$\frac{n}{V}$计算Al3+的物质的量浓度,然后根据c(Al3+):c(SO42-)=2:3计算SO42-的物质的量浓度.
解答 解:mg铝离子的物质的量为$\frac{m}{27}$mol,Al3+的物质的量浓度为$\frac{\frac{m}{27}}{V}$=$\frac{m}{27V}$mol/L,根据c(Al3+):c(SO42-)=2:3可知,SO42-的物质的量浓度为$\frac{m}{27V}$mol/L×$\frac{3}{2}$=$\frac{m}{18V}$mol/L,
故选D.
点评 本题考查常用化学计量的有关计算、分子中原子数目的计算、阿伏伽德罗定律等,明确各个物理量之间的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
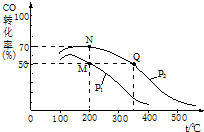 “洁净煤技术”研究在世界上相当普遍.
“洁净煤技术”研究在世界上相当普遍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的溶解性为难溶,则该物质的溶解度为0 | |
| B. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 | |
| C. | 通过沉淀反应能将大部分杂质离子沉淀 | |
| D. | 难溶电解质的溶度积越小,溶解度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
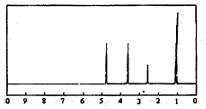
| A. | A分子属于酯类化合物 | |
| B. | A在一定条件下可与H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有一种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com