
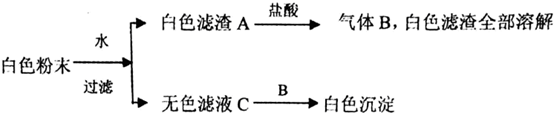
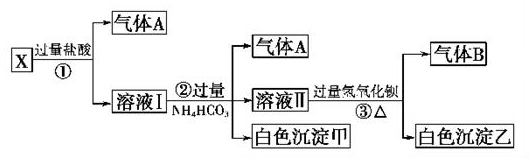
| A. | BaCl2,CaCO3一定存在,NaOH可能存在 | |
| B. | K2SO4、CuSO4一定不存在 | |
| C. | K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在 | |
| D. | C为单一溶质溶液 |
分析 由流程可知,白色固体溶于水的无色溶液,则一定不含CuSO4,滤渣A与盐酸反应生成气体B,且滤渣全部溶解,则A为CaCO3,B为CO2,原固体一定不含BaCl2、K2SO4中的一种,且滤液C与二氧化碳反应生成白色沉淀,可知C中含BaCl2、NaOH,以此来解答.
解答 解:A.由上述分析可知,NaOH、BaCl2、CaCO3一定存在,故A错误;
B.由上述分析可知K2SO4、CuSO4一定不存在,故B正确;
C.NaOH、CaCO3、BaCl2一定存在,K2SO4、CuSO4一定不存在,故C错误;
D.氯化钡与二氧化碳不反应,而C与二氧化碳反应生成白色沉淀,可知C中溶质为BaCl2、NaOH,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、白色固体的判断为解答的关键,侧重分析与应用能力的考查,注意C中溶质为两种及元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
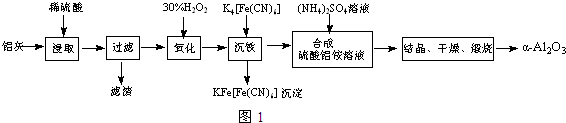
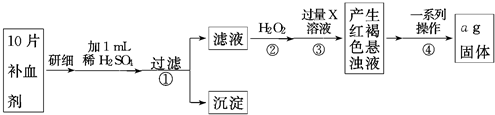
 (2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.
(2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫OH-+SO2=HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+=Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 | |
| B. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| C. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 | |
| D. | 将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{N}{{N}_{A}}$表示该气体的物质的量 | |
| B. | $\frac{M}{{N}_{A}}$表示该气体一个分子的质量 | |
| C. | $\frac{\frac{m}{N}}{\frac{1}{12}m(C)}$表示该气体的相对分子质量 | |
| D. | $\frac{m}{N}$表示该气体所含原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com