
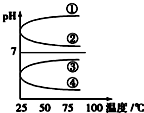
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:分析 (1)根据中和酸性物质A只有NaOH、NH3•H2O,浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,则C为H2SO4;根据浓度均为0.1mol•L-1A和E溶液,pH:A<E,则A为HCl,E为CH3COOH;
(2)①加水促进氨水电离,则n(NH3•H2O)减少,n(OH-)增大,;
②加水促进氨水电离,则n(NH3•H2O)减少,n(OH-)增大,c(NH3•H2O)、c(OH-)都减小,c(H+)减小;
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变;
④由NH3•H2O?OH-+NH4+可知,加水促进电离;
(3)c(OH-)和体积均相等的两份溶液A和E,A为HCl,E为CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸浓度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,据此回答即可;
(4)氯化钠和氢氧化钠的混合物,升高温度,碱性增强,根据pH=-lgc(H+)来分析.
解答 解:(1)根据①确定B、A为HCl、H2SO4两种酸,中和酸性物质A只有NaOH、NH3•H2O,即B是一元碱,根据浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,则C为H2SO4,根据浓度均为0.1mol•L-1A和E溶液,pH:A<E,则A为HCl,
故答案为:HCl;NaOH溶液;
(2)①、B溶液为氨水溶液,由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,则$\frac{c({B}^{-})}{c(O{H}^{-})}$=$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$减小,故①正确;
②、由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,c(NH3•H2O)、c(OH-)都减小,c(H+)减小,则$\frac{c(O{H}^{-})}{c({H}^{+})}$减小,故②正确;
③、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④、由NH3•H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)c(OH-)和体积均相等的两份溶液A和E,A为HCl,E为CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸浓度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,
①反应所需要的时间醋酸短:E<A,故①错误;
②开始氢离子浓度相同,反应时的速率相同:A=E,故②错误;
③生成氢气相同,结合电子守恒,参加反应的锌粉的物质的量:A=E,故③正确;
④反应过程的平均速率,醋酸大于盐酸:E>A,故④正确;
⑤最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,A溶液中有锌粉剩余,故⑤正确;
⑥依据⑤分析可知E溶液中有锌粉剩余,故⑥错误;
故答案为:③④⑤.
(4)将等体积、物质的量浓度之比为1:2 的溶液HCl和NaOH溶液混合后,得到的是氯化钠和氢氧化钠的混合物,升高温度,碱性增强,但是水的离子积增大,所以溶液pH减小,故答案为:②.
点评 本题考查电解质溶液之间的反应,沉淀溶解平衡的溶度积计算,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
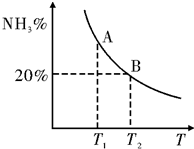 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa下氢气的燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| C. | 一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25NH4Cl溶液含NH4+物质的是不同 | |
| D. | 吸热反应“TiO2(g)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在体积可变的密闭容器中发生可逆反应 A(g)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | |
| B. | 对于反应 C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率可能减小 | |
| C. | 向 0.1 mol•L-1的氨水中加入氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}0)}$增大 | |
| D. | 常温下,向 Mg(OH)2悬浊液中加入 MgCl2浓溶液后,溶液中$\frac{c(M{g}^{2+})•c(O{H}^{-})}{c({H}^{+})}$不变(一定温度下,Mg(OH)2悬浊液中 c(Mg2+)﹒c2(OH-)为定值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4溶液显强碱性,能消毒杀菌 | |
| B. | Na2FeO4具有强氧化性,能消毒杀菌 | |
| C. | Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水 | |
| D. | Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
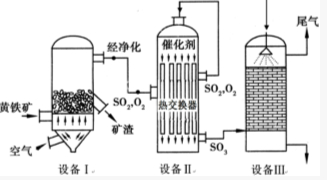 以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com