
| A. | 1molP4含有p-p键的个数为4NA | |
| B. | 1molSiC中含有C-Si键的个数为2NA | |
| C. | 含C为1mol的金刚石中含有C-C键的个数为2NA | |
| D. | 1molSi02中含Si-O键的个数为2NA |
分析 A、白磷分子式为P4,1mol白磷含有6molP-P键,由此解答;
B、1molSiC中含4molSi-C键来分析;
C、根据1mol金刚石含有2molC-C键进行判断;
D、根据1mol二氧化硅含有4molSi-O键分析.
解答 解:A、白磷分子式为P4,1mol白磷含有6molP-P键,即6NA条,故A正确;
B、Si能形成4条Si-C键,故1molSiC中含4molSi-C键,即4NA条,故B错误;
C、金刚石中的碳都是与相邻的4个碳组成的四个共价键,但是每个共价键是两个C原子共用的,所以1mol碳原子就有2mol的C-C键,故C正确;
D、二氧化硅中,1molSi原子形成4molSi-O键,即含Si-O键的个数为4NA,故D错误;
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有溴元素,只需经过化学变化就可以得到高纯度的溴 | |
| B. | 海水淡化涉及到了化学变化 | |
| C. | 从海水中可以得到NaCl,除了食用外,还可以用于工业制氯气 | |
| D. | 海水中含有丰富的钠、镁、碘、金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
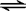 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的原子核都是由质子和中子组成的 | |
| B. | 原子的最外层电子数不超过8个 | |
| C. | 稀有气体原子的最外层电子数为2或8 | |
| D. | 原子的次外层电子数可能为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
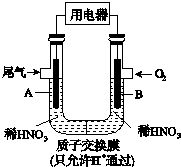 某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A. | 电解质溶液中电流的方向由B到A,电子的流向与之相反 | |
| B. | 电极A表面反应之一为NO-3e-+2H2O═NO${\;}_{3}^{-}$+4H+ | |
| C. | 电极B附近的c(NO${\;}_{3}^{-}$)增大 | |
| D. | 该电池工作时,每转移4 mol电子,消耗标准状况O222.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无沉淀生成,溶液显红色 | B. | 无沉淀生成,溶液显无色 | ||
| C. | 有沉淀生成,溶液显无色 | D. | 有沉淀生成,溶液显红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com